Нейроэндокринная регуляция репродуктивной системы |
|
|
Нейроэндокринная регуляция репродуктивной системы является чрезвычайно сложной. Все органы, привлеченные в репродуктивный процесс, имеют прямые и обратные связи:
1) центральная нервная система и надгипоталамические структуры мозга;
2) гипоталамус;
3) гипофиз;
4) яичники;
5) матка и другие органы-мишени.
В течение последних 3-х десятилетий было получено много новой информации, но данные относительно точного механизма сложных нейроэндокринных процессов постоянно меняются.
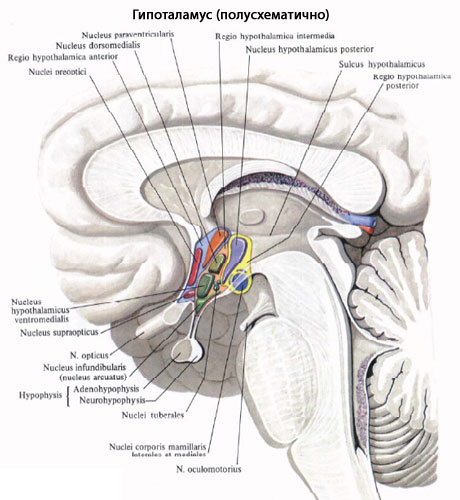
Гипоталамус
Гипоталамический контроль секреции гонадотропинов гипофизом осуществляется посредством гонадотропин-рилизинг гормона (ГнРГ).
Образование ГнРГ-декапептида кодируется геном, локализованным на коротком плече хромосомы 8. ГнРГ-рецепторы локализуются в гипофизе и многих органах репродуктивной системы. Нейроны, которые секретируют ГнРГ, находятся преимущественно в переднем, медиобазальном гипоталамусе и аркуатных ядрах. По аксонам этих нейронов ГнРГ транспортируется к медиальному повышению гипофиза, где достигает капилляров первичного портального сплетения.
Медиальное возвышение, или воронка, вместе с линковым стеблем и задней долей гипофиза образуют нейрогипофиз. Эти три компонента нейрогипофиза образуют общую капиллярную сетку и имеют прямое артериальное кровоснабжение из гипофизарных артерий. Капилляры медиального повышения имеют фенестрованый эпителий, как и периферические ткани, что позволяет пропускать большие молекулы. Эти капилляры отличаются от капилляров головного мозга, следовательно, медиальное повышение гипофиза находится вне гематоэнцефалического барьера.
Нервные клетки с гипоталамо-гипофизарного тракта секретируют ГнРГ непосредственно в портальную циркуляцию, откуда он переносится в клетки передней доли гипофиза. Медиобазальная часть передней доли гипофиза (аденогипофиз) получает кровь из портальных сосудов гипофиза и локализуется близко к основанию гипоталамуса и гипофизарного стебля. В отличие от нейрогипофиза, аденогипофиз не имеет прямого артериального кровоснабжения и получает кровь из портальных сосудов. Оставляя аденогипофиз, сосуды возвращаются к нейрогипофизарному капиллярному сплетения, позволяя гипофизарным гормонам участвовать в регуляции секреции ГнРГ медиальным повышением.
Дополнительно к этому основному пути существуют альтернативные пути транспорта ГнРГ. Аксоны гипоталамо-линкового тракта могут переносить ГнРГ прямо к третьему желудочку мозга. Специализированные эпендимальныеклетки — танициты — распространяются из полости третьего желудочка в дальнюю зону медиального повышения. Если ГнРГ попадает в третий желудочек, он транспортируется в портальную систему через микроворсинки таницитов. Итак, ГнРГ выделяется двумя путями: в большом количестве периодически через гипоталамо-линкового тракт (циклическое выделение) и в незначительном количестве постоянно через трансэпендемальную систему (тоническое выделение).
У женщины ГнРГ секретируется в пульсационном режиме и имеет период полувыведения 2-4 мин. Амплитуда и частота импульсов варьирует в течение менструального цикла, частота является большей в фолликулярной фазе (1 импульс за 1 ч) и в меньшей в лютеиновой фазе (1 импульс за 2-3 ч). Пульсация ГнРГ взаимодействует с секрецией гонадотропинов. Так, при ежечасно экзогенном введении ГнРГ возникает пик секреции гонадотропинов, характерный для овуляторной фазы менструального цикла, а при введении ГнРГ с частотой 5 импульсов в час секреция гонадотропинов подавляется.
При уменьшении частоты введения ГнРГ до 3 импульсов в час уровень лютеинизирующего гормона (ЛГ), или лютропина, уменьшается, а уровень фолликулостимулирующего гормона (ФСГ), или фолитропина, растет; не возникает овуляторного пика секреции гонадотропинов. Уменьшение количества экзогенного ГнРГ также подавляет выделение гонадотропинов гипофизом.
Женщины с ановуляцией и гипоталамической аменореей, а также с аменореей невыясненного происхождения имеют нарушения частоты и (или) амплитуды выделения ГнРГ. Следовательно, контроль эпизодической секреции ГнРГ является очень важным для поддержания нормальной овуляторной цикличности. Амплитуда и частота ГнРГ-секреции гипоталамусом регулируется обратной связью как с яичниковыми стероидами — эстрадиолом и прогестероном, так и с гипофизарным гонадотропинами гуморальным путем. Амплитуда и частота импульсов ГнРГ регулируется также неврогенным путем с помощью нейротрансмиттеров и нейромодуляторов головного мозга.
Нейротрансмиттеры
Наиболее важными нейротрансмиттерами, участвующими в регуляции функции репродуктивной системы, есть два катехоламина: допамин и норэпинефрин, а также один индоламин — серотонин. Все три нейротрансмиттера является моноаминами. Допамин и норэпинефрин образуются путем конверсии тирозина в среднем мозге. Фермент тирозин-гидроксилаза конвертирует тирозин до (3,4-дигидроксифенилаланин) (допа), который затем декарбоксилируется до допамина. Важным коферментом этого процесса является пиридоксин. Допамин-оксидаза конвертирует допамин в норэпинефрин. Норэпинефрин потом конвертируется в эпинефрин путем добавления метиловой группы с помощью фермента метилтрансферазы.
Предшественником серотонина является триптофан, который сначала конвертируется в 5-гидрокситриптофан с помощью энзима триптофан-гидроксилазы, что в свою очередь, декарбоксилируется с образованием серотонина. Основным метаболитом серотонина является 5-гидроксииндолуксусная кислота, которая может быть определена в моче.
Серотонин непосредственно не влияет на выделение ГнРГ, но он способствует выделению пролактина, возможно, путем стимуляции секреции гипоталамического пролактин-рилизинг-фактора.
Внутривенное введение допамина как у мужчин, так и у женщин, приводит к уменьшению уровня циркулирующего пролактина и гонадотропинов. Допамин не оказывает прямого действия на секрецию гонадотропинов передней долей гипофиза, его действие модулируется путем ингибирования выделения ГнРГ гипоталамусом. Хотя точная химическая структура эндогенного пролактин-ингибирующего гормона еще неясна, считают, что дофамин играет роль гипоталамического ингибитора секреции пролактина.
Влияние нейротрансмиттеров на секрецию гипоталамических гормонов может осуществляться несколькими механизмами. Одним из возможных механизмов является прямая межклеточная взаимодействие или мультисинаптическая связь, где нейротрансмиттеры выделяются терминальными нервами и недеполяризующимии рецепторами гипоталамических клеток. Деполяризация происходит при высвобождении специфического гормона гипоталамическими клетками. Этот специфический эффект нейротрансмиттеров на гипоталамические клетки может быть поврежден системным назначением некоторых медикаментов. Так, метилдоп блокирует синтез допамина и норэпинефрина путем ингибирования фермента тирозин-гидроксилазы. И резерпин и хлорпромазин действуют с норэпинефрином, допамином и серотонином, связываясь и накапливаясь.
Трициклические антидепрессанты ингибируют нейротрансмиттеры, тогда как такие препараты, как пропранолол, фентоламин, галоперидол действуют путем блокирования рецепторов на уровне гипоталамуса. Следовательно, при применении таких медикаментов у пациенток могут иметь место галакторея, олиго- и аменорея. Этот клинический эффект развивается как вследствие гиперпролактинемии, так и вследствие нарушения секреции ГнРГ.
Нейромодуляторы
Опиоиды. Рецепторы к опиоидным пептидам находятся в головном мозге. Выделяют 3 группы опиатов: энкефалины, эндорфины (а, р, у) и динорфины. Р-эндорфин (Р-ЭР) состоит из 31 аминокислоты и в 5-10 раз активнее морфина. Он концентрируется преимущественно в аркуатных ядрах и медиальном повышении гипоталамуса, а также в гипофизе.
р-ЭР проявляют также в плаценте, поджелудочной железе, желудочно-кишечном тракте и семенной жидкости. Концентрация р-ЭР в гипофизе почти в 1000 раз выше, чем в гипоталамусе. Инфузия р-ЭР вызывает рост уровня пролактина и уменьшение ЛГ; последний осуществляет ингибиторный эффект на ГнРГ-нейроны в гипоталамусе. Полагают, что опиаты угнетают высвобождение ГнРГ путем воздействия на синтез катехоламинов, особенно норадреналина. Периферический уровень р-ЭР в плазме крови не соответствует таковому в сосудах центральной нервной системы (ЦНС).
Введение антагонистов опиоидов, например, налоксона, дозой более 1 мг / ч блокирует мозговую опиоидной активность и вызывает увеличение ЛГ в позднюю фолликулиновую и лютеиновую фазу, но не в раннюю фолликулиновую фазу и не у женщин в постменопаузе. Итак, эстрогены и прогестерон способствуют росту уровня р-ЭР в головном мозге. Рост уровня р-ЭР может быть связан с уменьшением пульсации ГнРГ в лютеиновой фазе.
Простагландины. Уровень простагландинов в гипоталамусе может модулировать выделение ГнРГ. Назначение простагландина Е2 приводит к значительному подъему уровня ГнРГ в портальной циркуляции. Более того, физиологическая роль простагландинов в регуляции или модуляции секреции ГнРГ доказывается тем, что в эксперименте на крысах и овцах овуляторный пик ЛГ может быть ликвидирован при назначении аспирина или индометацина, которые блокируют синтез простагландинов. Данные о влиянии ингибиторов простагландинов и ингибиторов-простагландин-синтетазы на секрецию гонадотропинов у человека отсутствуют.
Катехолэстрогены. Катехолэстрогены — сложные 2-гидроксиестрадиол и 2-гидрокси эстрон, а также их 3-метоксидериваты присутствуют в гипоталамусе в большей концентрации, чем простагландины Е1 и Е2. Полагают, что эти вещества могут действовать как нейромодуляторы путем регуляции функции катехоламинов через инактивацию тирозин-гидроксилазы и активацию энзима катехол-О-метилтрансферазы. Но данных о том, что катехолэстрогены имеют значительное влияние на нейромодуляцию репродуктивной функции, недостаточно.
Мозговые пептиды. Многочисленные пептиды могут действовать как нейротрансмиттеры, но большинство из них действуют на локальном уровне путем регуляции аутокринных и паракринных функций. Хотя синтез и секреция гипофизарных гормонов контролируются преимущественно классической системой гормональных мессенджеров, существуют также существенные локальные межклеточные взаимодействия. К мозговым пептидам, которые действуют как нейротрансмиттеры, принадлежат нейропептид В, ангиотензин II, соматостатин, активин, ингибин, фолистатин и галанин.
Нейропептид В. Нейропептид В стимулирует пульсационную секрецию ГнРГ и в гипофизе потенцирует ответ гонадотропинов на ГнРГ. Таким образом, он может способствовать секреции ГнРГ и гонадотропинов. При отсутствии эстрогенов нейропептид В подавляет секрецию гонадотропинов. Увеличенные уровни нейропептида У были обнаружены в спинномозговой жидкости женщин с нервной анорексией и булимией, поэтому считают, что нейропептид В является одним из факторов, связывающих нарушения питания с нарушениями репродуктивной функции.
Ангиотензин II. Несколько компонентов ренин-ангиотензиновой системы присутствуют в головном мозге. Рецепторы ангиотензина II найдены в нескольких типах гипофизарных клеток. Это дает возможность предположить, что ангиотензин II влияет на секрецию гипофизарных гормонов путем локального действия. Кроме того, в гипоталамусе ангиотензин II влияет на действие норэпинефрина и допамина по высвобождению факторов, контролирующих секрецию гонадотропинов и пролактина.
Соматостатин. Это гипоталамический пептид, который подавляет выделение гормона роста, пролактина и тиреотропного гормона (ТТГ, или тиреотропина), гипофизом.
Активин и ингибин. Это пептиды, образующиеся яичниками и являются пептидными представителями семейства факторов роста-р. Эти пептиды имеют противоположное действие на секрецию ФСГ. Ингибин избирательно уменьшает выделение ФСГ (но не ЛГ), а активин стимулирует синтез ФСГ (но не ЛГ).
Фолистатин — это яичниковый пептид, который еще называют ФСГ-подавляющим белком в связи с его действием: угнетением синтеза и секреции ФСГ, а также ответы ФСГ на ГнРГ. Фолистатин также связывает активин и, таким образом, уменьшает его активность.
Галанин. Галанин высвобождается в портальную циркуляцию в пульсационном режиме и положительно влияет на секрецию ЛГ.
Действие ГнРГ
Когда ГнРГ достигает передней доли гипофиза, он стимулирует секрецию ЛГ и ФСГ одними и теми же гипофизарной клетками. Итак, если гипоталамический контроль секреции пролактина может быть как подавляющим (преимущественно), так и стимулирующим, то гипоталамический контроль секреции гонадотропинов является лишь стимулирующим. Пептидные гормоны, такие как ГнРГ, связывают специфические рецепторы на поверхности мембраны клеток-мишеней, в отличие от стероидных гормонов, проходящих через клеточную мембрану и связывающихся с внутриклеточными рецепторами.
Рецепторы протеиновых гормонов имеют высокую молекулярную массу (200 000-300 000 дальтон), и каждый рецептор связывается с 1 молекулой протеина. Полипептидные гормоны, такие как ЛГ, ФСГ и пролактин, хотя и имеют некоторую степень растворимости в жидкостях организма, характеризуются низкой растворимостью в липидах, и поэтому не могут быстро проходить через липидный барьер плазматических мембран клеток-мишеней.
После связывания протеинового гормона со своим рецептором, комплекс гормон-рецептор проходит через клеточную мембрану для защиты ее от других воздействий. Этот процесс называется интернализации. Кроме интернализации гормон-рецепторного комплекса, гормональный сигнал может быть перенесен в клетку путем трансмембранных сигналов с помощью продукции внутриклеточных и внеклеточных мембраносвязанных вторичных мессенджеров. Когда протеиновый гормон связывается со специфическим рецептором, он активирует или подавляет фермент аденилатциклазу, (вторичный мессенджер).
Затем цАМФ активирует протеинкиназу в цитоплазме путем связывания ее регуляторной субъединицы (вызывает диссоциацию этой субъединицы с ее катализирующей субъединицей). Когда регуляторная единица протеинкиназы освобождается от ее катализирующей субъединицы, последняя получает способность передавать фосфаты с аденозинтрифосфата (АТФ) в протеиновый субстрат.
Искусственно синтезированные препараты — аналоги (агонисты) ГнРГ — имеют большую (в 15-200 раз) активность и длительный период полувыведения (1, 3, 6 ч), чем ГнРГ. Агонисты сначала стимулируют выделение гонадотропинов (вспышка). Этот эффект длится 1-3 нед. После того, как ГнРГ-рецепторы становятся насыщенными аналогами, постоянно назначаются, стимулирующий эффект периодического высвобождения эндогенного ГнРГ в гипофиз блокируется. Этот процесс получил название десенситизации или обратной регуляции. Этот эффект лежит в основе клинического назначения аналогов ГнРГ при различных стероид-гормонозависимых патологических состояниях. Первый агонист ГнРГ люпролид-ацетат был применен в 1985 для паллиативного лечения рака предстательной железы, а также лечения эндометриоза и миомы матки (3,75-7,5 мг 1 раз в месяц).
Усилия по синтезу антагонистов ГнРГ затрудняют развитие аллергической реакции, связанной с высвобождением гистамина. Клиническое применение антагонистов ГнРГ фокусируется на вспомогательных репродуктивных технологиях для обратной регуляции гипоталамо-гипофизарной оси течение цикла стимуляции яичников. Новые показания для применения антагонистов ГнРГ в клинической практике, в том числе для лечения миомы матки, находятся в стадии изучения.



