Особенности клинической эффективности применения пиоглитазона в комплексной терапии больных с ишемической болезнью сердца на фоне метаболического синдрома |
|
|
За прошедшие десятилетия распространенность ишемической болезни сердца (ИБС) стремительно растет как в большинстве стран, так и в Украине. Одним из возможных факторов риска развития ИБС является метаболический синдром (МС), который значительно повышает риск развития ИБС (риск составляет 2,13) [1–3]. Сочетание ИБС и МС широко распространено в повседневной клинической практике, причем такое состояние существенно утяжеляет клиническое течение и усложняет подходы к рациональной терапии, снижает эффективность современных методов лечения ИБС [4–6]. Поэтому актуальной проблемой современной медицины является разработка терапии ИБС, протекающей на фоне МС, поскольку требуется прицельное воздействие как на общие звенья патогенеза этих заболеваний, так и на специфические процессы в сердечно-сосудистой и иммунонейроэндокринной системах [7, 8].
Лечение и профилактика ИБС требуют обязательного воздействия на такие состояния, как ожирение, сахарный диабет (СД), дислипидемия и гипертензия, которые объединяют термином МС. Модификация этих состояний позволяет существенно снизить сердечно-сосудистые риски [9]. В настоящее время на основе данных последних клинических исследований (R. Tota-Maharaj et al., 2010) сформирован современный комплексный подход к лечению МС, включающий применение ацетилсалициловой кислоты, фибратов и статинов; диета и изменение образа жизни остаются краеугольными камнями [10].
Одним из перспективных направлений терапии ИБС на фоне МС является воздействие на системный воспалительный ответ и связанные с ним гиперлипидемию и инсулинорезистентность. Сегодня в терапии для регуляции данных процессов достаточно успешно используют тиазолидиндионы — агонисты рецепторов, активирующих пролиферацию пероксисом-g (ППАР-g). Наиболее эффективным и безопасным с точки зрения сердечно-сосудистых рисков является пиоглитазон [10]. В исследованиях PERISCOPE и PROactive было показано, что пиоглитазон снижает смертность, вызванную разными причинами, частоту нефатальных инфарктов миокарда и инсультов у пациентов с СД 2-го типа и высоким риском микрососудистых осложнений [11]. По поводу же применения других тиазолидиндионов, а именно розиглитазона, особенно у больных с ИБС, продолжаются клинические исследования и дискуссии, связанные с возможными сердечно-сосудистыми рисками [12].
Поэтому целью данного исследования стало изучение особенностей клинической эффективности пиоглитазона в комплексной терапии ИБС в сочетании с МС для улучшения результатов лечения.
Материалы и методы
В клиническом исследовании принимали участие 55 лиц обоих полов в возрасте 45–65 лет, которые страдали ИБС в сочетании с МС. Исследованные пациенты были рандомизированы на группу сравнения (n = 27) и группу наблюдения (n = 28). Исследование проводилось в период с 2008 по 2010 гг. на базе 1-й городской клинической больницы г. Полтавы и Научно-исследовательского института генетических и иммунологических основ развития патологии и фармакогенетики Украинской медицинской стоматологической академии. Перед началом исследования было получено одобрение комиссии по биоэтике этого учреждения.
Диагноз ИБС у пациентов ставился согласно критериям ВОЗ, а МС — согласно модифицированным критериям Американской ассоциации кардиологов [13] и Международной диабетической ассоциации (IDF).
До включения в клиническое исследование все больные получали общепринятое лечение и проходили скрининговое обследование для верификации диагнозов ИБС и МС. После чего им назначали стандартный комплекс медикаментозной терапии: изосорбида динитрат 20 мг 2 раза в день, ацетилсалициловая кислота 75 мг 1 раз в день на ночь, амлодипин 10 мг 1 раз в день, бисопролол 2,5–5 мг 1 раз в день, аторвастатин 10 мг 1 раз в день утром. Общепринятое лечение больные принимали не менее месяца до достижения стабильных показателей.
Клиническое обследование и взятие образцов крови пациентов проводили в первый день исследования. После клинического и лабораторного исследования пациенты были рандомизированы: группа сравнения продолжала получать только стандартный комплекс терапии, а группе наблюдения в комплексную терапию был добавлен пиоглитазон в дозе 30 мг 1 раз в день (пиоглар, ранбакси). Повторное обследование выполнялось через 3 месяца. У больных оценивались антропометрические показатели — рост, вес, окружность талии, окружность бедер, рассчитывали индекс массы тела (ИМТ). Все больные были обследованы общеклинически, что включало: общий анализ крови, мочи, анализ крови и мочи на глюкозу, биохимический анализ крови, общий холестерин, a-холестерин, триглицериды, b-липопротеиды, общие липиды, УЗИ почек, сердца, ЭКГ. Все методы были рутинными и направлены на верификацию и установление степени тяжести основного заболевания, а также выявление сопутствующей патологии.
Характер изменений течения ИБС оценивали по функциональному классу стенокардии напряжения, наличию экстрасистол, мерцательной аритмии, тяжести артериальной гипертензии, тяжести сердечной недостаточности.
Исследование изменений липидного обмена у пациентов проводилось биохимическими методами при помощи определения концентрации общего холестерина, холестерина липопротеидов высокой плотности (ЛПВП), общих липидов, триглицеридов, b-липопротеидов в сыворотке крови при помощи наборов реагентов («Био-Ла-Тест», Чехия).
Углеводный обмен исследовали при помощи определения концентрации глюкозы в крови пациентов. Концентрацию С-пептида определяли в сыворотке иммуноферментным методом (DRG, CIF). Уровень иммунореактивного инсулина в сыворотке оценивали с помощью тест-систем Insulin Elisa (DRG, США).
Изучение иммунного и воспалительного ответа проводили путем определения следующих биомаркеров: концентрация церулоплазмина (ЦП) в сыворотке методом колориметрии [14], высокочувствительный С-реактивный белок (В-СРБ) определяли иммуноферментным методом с помощью тест-системы (DRG, США), а также количественный уровень ФНО-a определяли иммуноферментным методом при помощи набора реагентов (ЗАО «Вектор-Бест», Россия).
Статистическую обработку результатов исследования проводили при помощи стандартной программы STATISTICA 6,0 (StatSoft, США) с расчетом среднего арифметического, среднеквадратического отклонения, вероятности полученных результатов Т-тестом для попарно связанных и независимых величин (t). Для отдельных показателей достоверность отличий рассчитывали непараметрическими методами по Уилкоксону и Манну — Уитни. Данные приведены в виде среднего стандартного отклонения, нижнего и верхнего квартилей.
Результаты и их обсуждение
На визите рандомизации пациенты проходили клиническое и лабораторное обследование и были разделены на группу сравнения, продолжавшую стандартную терапию, и группу наблюдения.
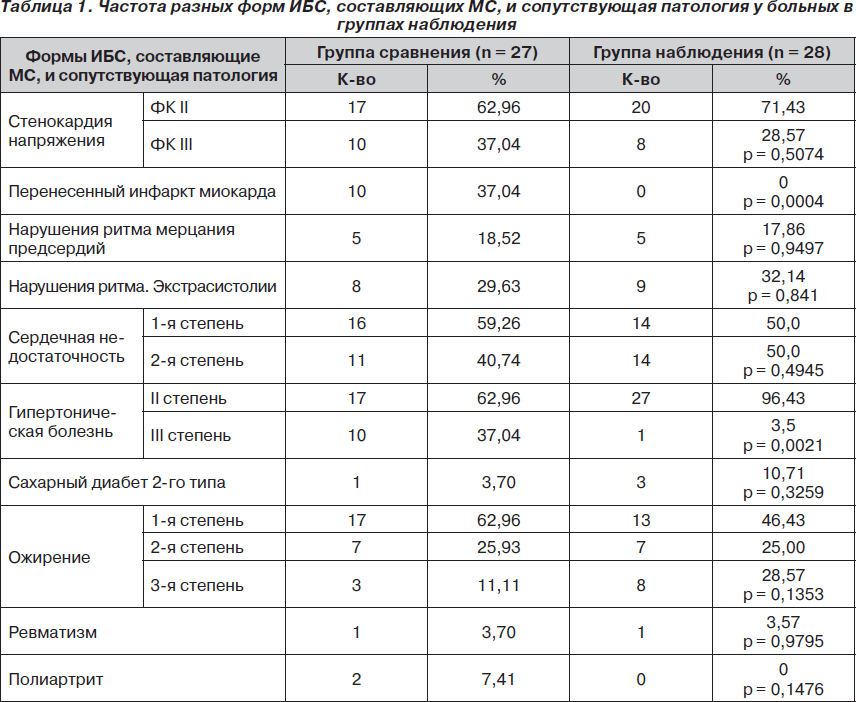
По уровню представленности в группах различных форм ИБС, составляющих МС, и сопутствующей патологии, группы не различались между собой за исключением наличия перенесенного инфаркта миокарда и гипертонической болезни III степени, частота которых была достоверно выше в группе сравнения (табл. 1).
Также не было выявлено различий по продолжительности заболевания ИБС и гипертонической болезнью.
После проведения рандомизации группа наблюдения начинала прием пиоглитазона на фоне стандартной терапии в течение 3 месяцев, а группа сравнения продолжала прием стандартной терапии.
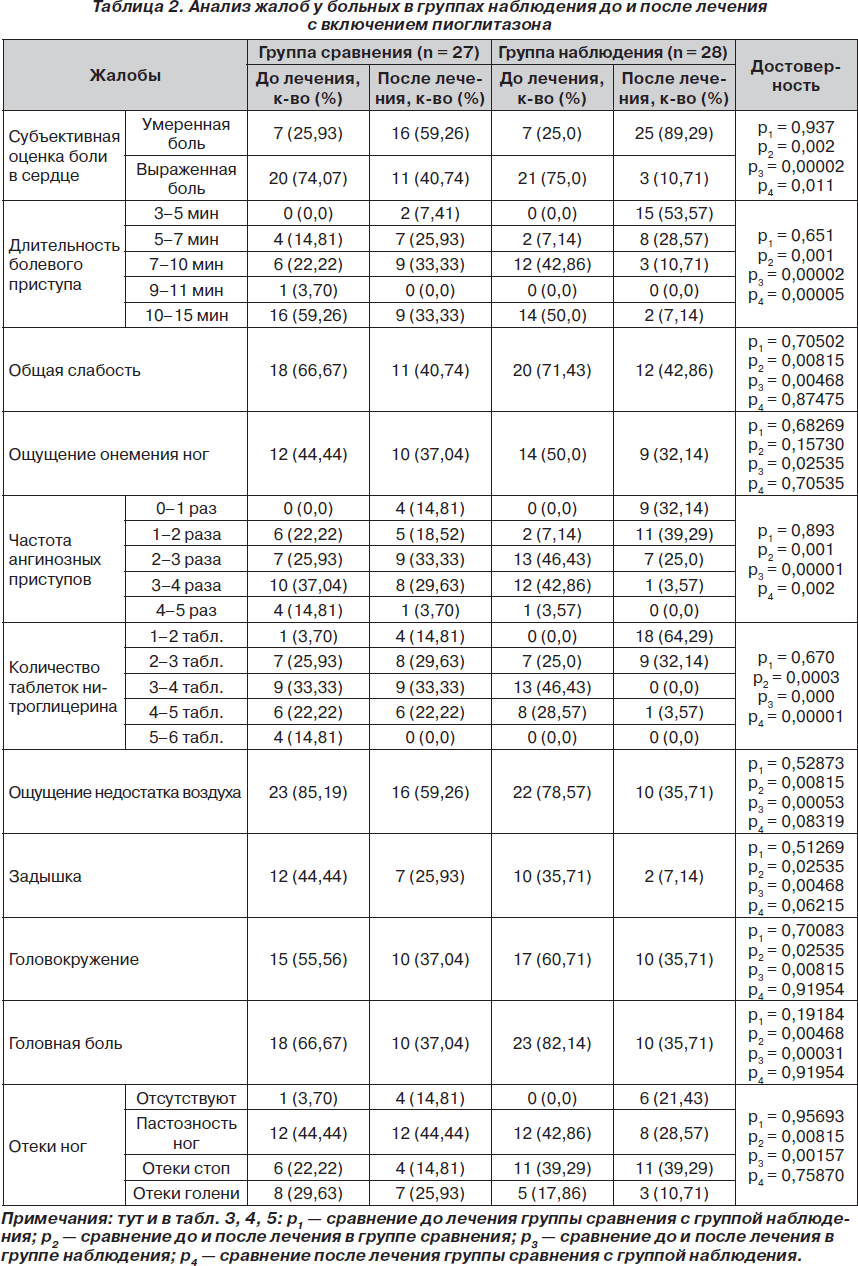
При анализе жалоб пациентов отмечено, что в процессе лечения пациенты обеих групп стали предъявлять достоверно меньше жалоб на боль, сократилась длительность болевых и ангинозных приступов, уменьшилось число таблеток нитроглицерина для купирования приступов (табл. 2). Причем в группе наблюдения эти показатели под действием пиоглитазона улучшались достоверно и по отношению к группе сравнения.
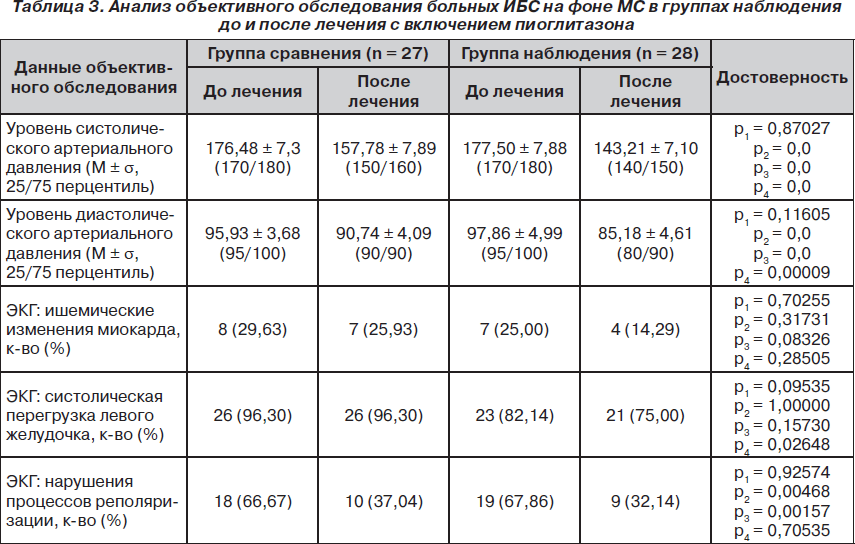
Также оценивали изменение уровней артериального давления и ЭКГ-синдромов (табл. 3). Группы сравнения и наблюдения исходно достоверно не различались между собой.
В процессе стандартной терапии отмечали нормализацию артериального давления (преимущественно систолического) и уменьшение частоты нарушений процессов реполяризации (р = 0,00468) (табл. 3).
Добавление к стандартной терапии пиоглитазона приводило к более выраженной нормализации артериального давления, умеренному снижению систолической перегрузки левого желудочка и достоверному уменьшению частоты нарушений процессов реполяризации.
Таким образом, у пациентов с ИБС на фоне МС пиоглитазон не вызывал увеличения частоты неблагоприятных сердечно-сосудистых событий в течение трехмесячного курса. Включение пиоглитазона в комплексную терапию таких пациентов приводило к снижению функционального класса стенокардии напряжения и класса сердечной недостаточности, уменьшению числа ангинозных приступов, дозы нитроглицерина для купирования приступов. Кроме того, среди больных, принимающих пиоглитазон, быстрее нормализовалось артериальное давление и уменьшилась частота ЭКГ-синдромов.
С учетом данных предыдущих исследований о необходимости дальнейшей оценки преимущества включения пиоглитазона в терапию МС и СД 2-го типа полученные нами данные подтверждают перспективность такого подхода [15]. Ранее отмечалось, что добавление пиоглитазона у больных СД 2-го типа на метформине вызывает выраженное снижение артериального давления, не приводящее к компенсаторной тахикардии [16].
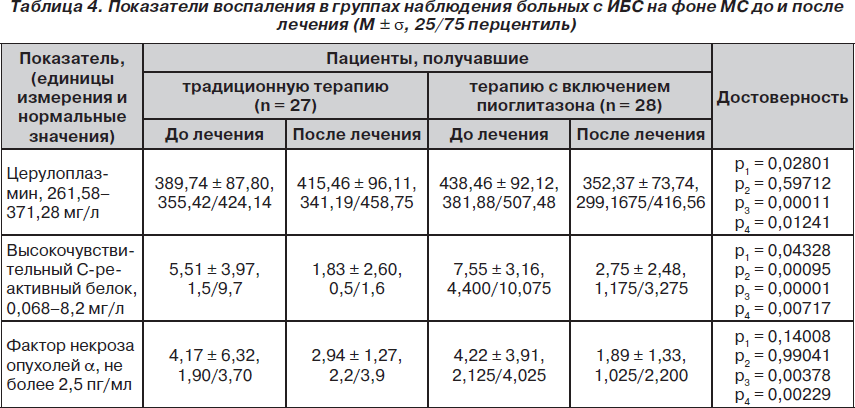
На следующем этапе были изучены показатели, характеризующие уровень системного воспаления, присущего ИБС и МС, такие как церулоплазмин, В-СРБ и ФНО-a (табл. 4). Как показали проведенные исследования, пациенты обеих групп имели в целом повышенные значения всех биомаркеров, за исключением В-СРБ в группе, получавшей стандартную терапию (верхний квартиль превышал показатели нормы). Показатели концентрации ЦП и В-СРБ в группе наблюдения достоверно превышали показатели группы сравнения.
В ходе трехмесячной стандартной терапии было выявлено достоверное снижение сывороточной концентрации В-СРБ (p = 0,00095), другие показатели изменялись недостоверно. В группе пациентов, принимавших пиоглитазон, отмечено достоверное снижение уровня системного воспаления по показателям всех биомаркеров. Более того, снижение уровня биомаркеров было достоверно не только внутри группы, но и с группой сравнения.
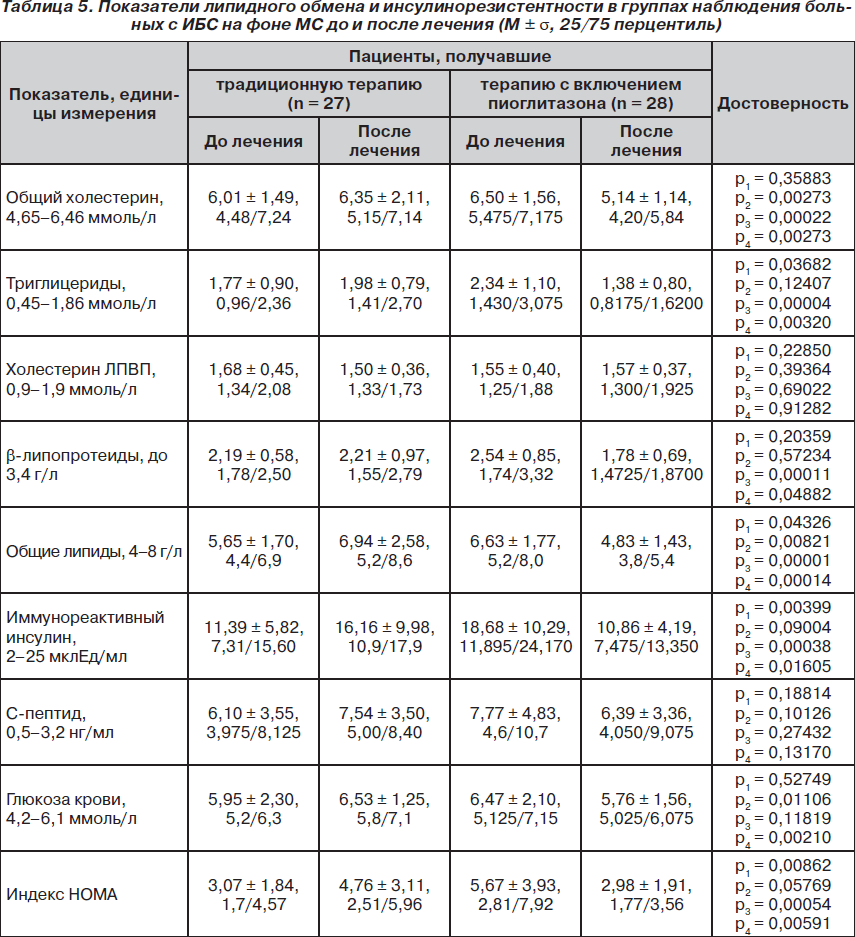
Важным определяющим фактором развития ИБС, МС и атеросклероза является нарушение липидного обмена. В группах пациентов до лечения показатели общего холестерина, холестерина ЛПВП, b-липопротеидов, триглицеридов и общих липидов были изменены незначительно (за исключением триглицеридов в группе наблюдения, верхний квартиль превышал норму приблизительно в 1,6 раза) (табл. 5).
В группе сравнения за период лечения не наблюдалось улучшения показателей липидного обмена, более того, уровень общего холестерина и общих липидов достоверно, но незначительно ухудшался. В группе клинического наблюдения отмечена положительная динамика таких показателей, как общий холестерин, b-липопротеиды, триглицериды и общие липиды. При этом хотя группы изначально отличались по более высоким уровням триглицеридов и общих липидов, применение пиоглитазона снизило эти показатели по отношению группы сравнения (p = 0,00320 и p = 0,00014 соответственно).
Важнейшим фактором патогенеза МС является состояние инсулинорезистентности, характеризующееся гиперинсулинемией, повышением уровней С-пептида и глюкозы натощак. Данные о концентрации этих веществ у пациентов, находившихся под наблюдением, представлены в табл. 5. Как видно из представленных данных, группы сравнения и наблюдения не различались по уровню глюкозы и С-пептида в сыворотке крови, но уровень инсулина в группе наблюдения был достоверно выше — 11,39 ± 5,82 мклЕд/мл и 18,68 ± 10,29 (р = 0,00399). В процессе стандартной терапии наблюдалось дальнейшее ухудшение показателей углеводного обмена, уровень глюкозы крови достоверно увеличивается с 5,95 ± 1,30 до 6,53 ± 1,25 ммоль/л (р = 0,01106). В группе наблюдения, пациенты которой принимали пиоглитазон, отмечалось снижение концентрации иммунореактивного инсулина (р = 0,00038) при недостоверном снижении уровней С-пептида и глюкозы крови.
Таким образом, пациенты с ИБС, протекавшей на фоне МС, в условиях предварительной стандартной терапии имели повышенную массу тела, увеличенные окружности талии и бедер, повышенные индексы массы тела и соотношение окружности талии к окружности бедер. У этих пациентов отмечалось повышение концентрации биомаркеров воспаления (ЦП, В-СРБ, ФНО-a) разной степени. Показатели липидного обмена в группах до лечения были изменены незначительно, что мы объясняем эффектом предварительной стандартной терапии с включением аторвастатина. Кроме того, отмечалось повышение концентрации инсулина, С-пептида и глюкозы крови. В целом все обнаруженные изменения лабораторных показателей были характерны для МС [17, 18].
Трехмесячная стандартная терапия, включающая антиагрегант, нитрат, бета-блокатор и статин, не приводила к дальнейшим прогрессивным улучшениям антропометрических показателей, показателей липидного обмена и инсулинорезистентности, однако способствовала снижению концентрации В-СРБ. Снижение уровня В-СРБ может быть связано с плейотропными эффектами аторвастатина, среди которых системное противовоспалительное действие [19, 20].
Добавление к стандартной терапии пациентов с ИБС и МС пиоглитазона приводило к незначительным достоверным снижениям показателей массы тела, ИМТ, окружностей бедер и талии, их отношения. Для сравнения: в группе наблюдения, получавшей пиоглитазон, отмечалось достоверное снижение концентрации церулоплазмина, В-СРБ и ФНО-a. Также под действием препарата снижались концентрации в сыворотке крови триглицеридов, b-липопротеидов, общего холестерина и общих липидов, причем не только по сравнению с исходными показателями этих пациентов до лечения, но и с показателями группы сравнения после стандартной терапии. Назначение пиоглитазона эффективно воздействовало на процессы, связанные с инсулинорезистентностью, значительно снижались концентрация иммунореактивного инсулина и достоверно — уровень глюкозы в крови, что свидетельствовало об уменьшении степени выраженности инсулинорезистентности.
Полученные нами результаты хорошо согласуются с данными экспериментальных исследований о кардиопротекторном действии пиоглитазона, определяющемся его способностью блокировать активацию NF-kB, проявляющемся в снижении секреции противовоспалительных цитокинов — интерлейкина-1b, ФНО-a [21].
Ранее нами было обосновано использование концентрации церулоплазмина в качестве маркера системного воспаления при МС [22]. Полученные результаты свидетельствуют, что этот показатель также может быть применен для контроля за эффективностью лечения МС в сочетании с ИБС.
Обнаруженные нами достоверные изменения липидного обмена под действием пиоглитазона у пациентов с ИБС и МС соответствуют данным метаанализа, проведенного на 3092 пациентах с плохо контролируемым СД 2-го типа, который показал достаточно разнонаправленные изменения таких показателей, как общий холестерин, триглицериды, в отличие от холестерина ЛПВП, который не имел тенденций к изменению [23].
Снижение уровня инсулинорезистентности у пациентов с ИБС и МС под действием пиоглитазона подтверждается данными литературы [24].
Таким образом, применение пиоглитазона в комплексной терапии больных с ИБС и МС снижает уровень системного воспаления, липидного обмена и существенно редуцирует инсулинорезистентность. Включение пиоглитазона в комплексную терапию пациентов с ИБС (стенокардия напряжения) на фоне МС не приводит к возрастанию сердечно-сосудистых рисков и улучшает клиническое течение заболеваний, повышает эффективность стандартной терапии ИБС. Проведенное исследование позволяет рекомендовать включение пиоглитазона в комплексную терапию ИБС и МС.
Литература