Клінічне та біохімічне обґрунтування доцільності комплексного використання Цераксону і Корвітину в лікуванні гострого ішемічного інсульту |
|
|
Як відомо, найуспішнішим і єдино доказаним способом реканалізації інфарктзалежної церебральної артерії після тромботичної або емболічної оклюзії та відновлення мозкової перфузії в критично зниженій ішемізованій ділянці мозку є тромболізис із використанням рекомбінантного тканинного активатора плазміногену. Щоправда, широке використання тромболізису обмежується через жорстке 4,5-годинне терапевтичне вікно, підвищений ризик симптомного внутрішньомозкового крововиливу, наявність численних інших протипоказань. До того ж не завжди досягається швидка, повна і постійна реканалізація оклюзованої артерії. Саме тому існує нагальна необхідність розробки та впровадження терапевтичних стратегій, які були б спрямовані на біохімічні та молекулярні механізми, спровоковані оклюзією та зупинкою надходження енергетичних ресурсів (кисню, глюкози, АТФ) до клітин мозку. Це ініціює низку послідовно взаємозв’язаних нейрохімічних процесів, що зумовлюють прогресуюче ішемічне пошкодження тканини мозку протягом більш тривалого проміжку часу після розвитку ішемічного інсульту.
З огляду на прогресуючий розвиток відстрочених патофізіологічних процесів своєчасне втручання в етапи ішемічного каскаду, роз’єднання окремих його ланок із застосуванням лікарських засобів могло б запобігти або загальмувати механізми, що призводять до загибелі нейронів у ділянці ішемізованої тканини мозку. Препарати, фармакологічна дія яких спрямована на інгібіцію ішемічного каскаду на різних ланках, називають нейропротекторами. Медикаментозна нейропротекція не обмежується вузькими рамками 6-годинного терапевтичного вікна. Для полегшення наслідків ішемічного інсульту нейропротекторні препарати доцільніше призначати одразу після появи перших неврологічних симптомів, тобто на догоспітальному етапі та продовжувати в умовах стаціонару впродовж 10–14 діб.
Проте арсенал лікарських засобів протекторного ряду обмежений. Тривалий пошук таких засобів не виявив препарату, який був би ефективним при лікуванні інсульту в людини. У мультицентрових дослідженнях засобів із заявленою нейропротекторною активністю встановлено, що більшість із них ефективними були лише в експерименті, у клінічних випробуваннях ІІІ фази виявляли їх неефективність або виражені побічні дії [28, 37].
Водночас помилково було б ставити під сумнів значення і корисність нейропротекції для терапії інсульту в людей. У теперішній час продовжується ІІІ фаза рандомізованого плацебо-контрольованого клінічного дослідження стосовно антиоксидантної дії сечової кислоти зі сподіванням на можливість досягнення прийнятного співвідношення користі та ризику лікування гострого ішемічного інсульту [18]. Метааналіз результатів дослідження виявив помірну ефективність цитиколіну в лікуванні ішемічного інсульту [23]. Результати іншого відкритого рандомізованого клінічного дослідження показали, що внутрішньовенне застосування Корвітину у лікуванні гострого ішемічного інсульту вірогідно збільшує ймовірність повного відновлення неврологічних функцій на 90-й день спостереження [5]. Клінічне дослідження ефективності Цераксону (цитиколіну) і Корвітину продовжується.
Як відомо, гострий ішемічний інсульт супроводжується синергічним впливом на організм різних патофізіологічних механізмів. Тому специфіка цього захворювання диктує необхідність застосовувати в лікуванні комплекси лікарських засобів, що ефективніше впливатимуть на взаємозв’язані патобіохімічні та молекулярні механізми, що призводять до загибелі нейронів ішемізованої тканини мозку. Крім того, комплексна медикаментозна нейропротекція зможе ефективніше стимулювати репарацію нейронів, поліпшувати пластичність неураженої тканини головного мозку, сприяти активації полісинаптичних міжнейрональних зв’язків.
В останні роки були спроби одночасного використання в лікуванні гострого ішемічного інсульту три- або двокомпонентної комбінації різних нейропротекторів: цитиколіну, мексидолу та L-лізину есцинату [11]; Цераксону та актовегіну [6,13]; цитиколіну та німодипіну [16]. Результати цих нерандомізованих досліджень свідчать про деякий терапевтичний успіх. У недавно опублікованій роботі [1] повідомляється, що виправданою може бути комбінація цитофлавіну, актовегіну, гліатиліну, а в ідеальному варіанті — й церебролізину. Автор вважає, що використання цих засобів на догоспітальному етапі та застосування їх у певній послідовності розширює межі терапевтичного вікна. На наш погляд, така комбінація лікарських препаратів не враховує економічні витрати на лікування хворого і те, як вони співвідносяться з кінцевими результатами відновлення втрачених функцій під впливом нейропротекторного комплексу. До того ж ефективність деяких компонентів запропонованої комбінації, зокрема церебролізину, не підтверджена результатами великого сліпого плацебо-контрольованого багатоцентрового клінічного дослідження CASTA (Cerebrolysin in patients with Acute Ischemic Stroke in Asia), які доповідались у Сеулі (Південна Корея) у 2010 р. на 7-му Всесвітньому конгресі з інсульту. На відміну від попередніх спостережень із позитивними результатами застосування церебролізину в лікуванні гострого ішемічного інсульту [12, 31] дослідження CASTA, яке ґрунтувалось на обстеженні 1059 пацієнтів з інсультом помірної тяжкості і на аналізі параметрів Шкали тяжкості інсульту Національного інституту здоров’я США (NIHSS), модифікованої шкали Ренкіна (мШР), індексу Бартел (ІБ) (глобальний тест (ГТ)), на 90-й день спостереження показало відсутність ефекту від застосованого 10-денного внутрішньовенного курсового введення церебролізину по 30 мл хворим на гострий ішемічний інсульт. У штучно виділеній групі тяжкого інсульту виявлена лише позитивна тенденція до поліпшення (World Stroke Congress, Seoul, South Korea, October, 2010).
Отже, ефективність застосованих нейропротекторів (за винятком цитиколіну) та їх комбінацій не доведена результатами рандомізованих плацебо-контрольованих клінічних випробувань. Тому й досі актуальною залишається проблема адекватного підбору та комбінування ней-ропротекторних засобів, які могли б забезпечити ефект синергічності, вищий ступінь ефективності лікування гострого ішемічного інсульту.
Патобіохімічні та молекулярні механізми ураження ішемізованої тканини мозку
Як відомо, енергетичний дефіцит ішемізованої тканини мозку та надмірна глутаматна стимуляція зумовлюють масивне входження іонів кальцію всередину нейронів, розвиток Са2+-індукованої ексайтотоксичності, що спричиняє активацію внутрішньоклітинних фосфоліпаз А2, С і гідроліз фосфоліпідів (ФЛ) клітинних мембран до вільних жирних кислот — арахідонової кислоти [17].
Надалі каскад відстрочених патофізіологічних механізмів після розвитку гострого ішемічного інсульту поглиблюється внаслідок активації цитозольних фосфоліпаз, ліпоксигеназ та протеаз, мікроглії, залучення запальних клітин, утворення реактивних форм кисню, розвитку некерованої та некомпенсованої продукції вільних радикалів, ослаблення ендогенної системи антиоксидантного захисту нейронів, ініціації апоптозу, що спричиняє розширення зони інфарктного ядра [39].
Відстрочені патофізіологічні процеси розглядають як прозапальну реакцію тканини мозку на вогнище ішемії, що супроводжується активацією катаболічних мембранних ферментів із надлишковим утворенням арахідонової кислоти та її патогенних похідних.
Вміст арахідонової кислоти у тканині головного мозку у здорових людей дуже низький. В умовах гострої церебральної ішемії вона вивільняється із мембранних фосфоліпідів двома шляхами: із фосфатидилхоліну (ФХ)— каталізується кальційзалежним ферментом фосфоліпазою А2 [26] та із фосфатидилінозиту (ФІ) — за участю особливої фосфодіестерази типу фосфоліпази С [8]. Далі відбувається перетворення арахідонової кислоти двома шляхами: циклооксигеназним — за допомогою ферменту циклооксигенази-2 (ЦОГ-2) або ліпоксигеназним, що каталізується ферментом 5-ліпоксигеназою. Каскад цих перетворень зумовлює надлишкове утворення високоактивних біологічних субстанцій — ейкозаноїдів, серед яких виділяють три основні групи: простагландини (ПГ), тромбоксани (ТХ), лейкотрієни (ЛТ). Всі вони є локальними гормонами і поглиблюють ураження ішемізованої тканини мозку. Отже, зміни активності ферментів фосфоліпази А2 і С відіграють важливу роль в ушкодженні тканини головного мозку після гострої церебральної ішемії [41, 33].
Під впливом циклооксигенази з арахідонової кислоти синтезуються значна кількість простагландинів і тромбоксанів, а під дією ліпоксигенази — лейкотрієни, що справляють нейротоксичну дію.
Ейкозаноїди — це окислені похідні поліненасичених жирних кислот: ейкозотрієнової (С20:3), арахідонової (С20:4), ейкозопентаєнової (С30:5). В організмі людини головним попередником патогенних ейкозаноїдів є арахідонова кислота. За функцією вони різні. Зокрема, підвид простагландинів — простациклін інгібує агрегацію тромбоцитів, сприяє вазодилатації судин, знижує артеріальний тиск (АТ). Водночас тромбоксан А2 стимулює агрегацію тромбоцитів, зумовлює вазоконстрикцію, підвищує рівень АТ. Лейкотрієни мають виражену проагрегантну і хемоатрактантну дію, зумовлюють адгезію лейкоцитів до ендотелію венул, діапедез, підвищують судинну проникність, активують продукцію прозапальних білкових медіаторів, викликають запальну відповідь тканини, набряк, стимулюють активність ферменту циклооксигенази-2 з наступним підсиленням синтезу простациклінсинтетази, тромбоксансинтетази, збільшенням продукції тромбоксану А2, простацикліну та інших простагландинів. Лейкотрієни зумовлюють також різку активацію процесів пероксидного окислення ліпідів біомембран з утворенням токсичних клітинних вільних кисневих радикалів (гідроксил-радикал, супероксидний аніон-радикал, монооксид азоту та продукт їх взаємодії — пероксинітрит), що призводить до ослаблення захисних систем і розщеплення внутрішньоклітинних структур (ДНК, білків, фосфоліпідів), руйнації цитоскелета, а відтак і до необоротного ураження нейронів [19, 39, 20].
У світлі наведених даних на сьогодні з метою поліпшення лікування гострих ішемічних порушень мозкового кровообігу проводиться активний пошук адекватних комбінацій лікарських засобів ефективного гальмування деградації фосфоліпідів клітинних мембран, утворення арахідонової кислоти та її патогенних похідних — лейкотрієнів і ейкозаноїдів, зменшення продукції вільних радикалів. Комплексне застосування нейропротекторних засобів повинно передбачати корекцію активності ендогенних механізмів, які у фізіологічних умовах є регуляторними, а в патологічних — зумовлюють руйнування біологічних мембран нейронів, а відтак їх загибель.
Збереження структури і функції біологічних мембран — важливий напрямок нейропротекції
Як відомо, основними компонентами біологічних мембран є ліпідний бішар, білки і вуглеводи. Ліпіди становлять структурну основу й забезпечують функціонування клітинних мембран, виконують функцію діелектриків (електрична ізоляція), захисну й регуляторну функції [2].
У нервовій тканині порівняно з іншими тканинами людського організму вміст ліпідів дуже високий; особливо багатий на ліпіди головний мозок (до 60 %). Серед основних класів ліпідів біологічних мембран найпоширеніші гліцерофосфоліпіди. Найпростішим представником гліцерофосфоліпідів є фосфатидова кислота (ФК), що є важливим проміжним попередником у біосинтезі фосфоліпідів. У клітинах різних тканин основними ліпідними компонентами біологічних мембран усіх ссавців є такі фосфоліпіди: фосфатидилхолін (лецитин), фосфатиди-лінозит, фосфатидилетаноламін (ФЕА) (кефалін), фосфатидилсерин, сфінгомієлін (СМ) [3, 9].
Фосфатидилхолін є головним ліпідним компонентом біологічних мембран клітин вищих тварин і рослин, його вміст сягає понад 50 % від загальної кількості всіх фосфоліпідів. У руйнуванні клітинних мембран після гострого ішемічного інсульту та при хронічних неврологічних захворюваннях ключову роль відіграє катаболізм головного мембранного ФЛ — фосфатидилхоліну [30]. Гідроліз ФХ здебільшого зумовлений активацією цитозольної фосфоліпази А2, яка розщеплює його на арахідонову кислоту, а перетворення її циклооксигеназним шляхом призводить до утворення ейкозаноїдів (простагландин, тромбоксан А2) [26]. Ці похідні впливають на життєдіяльність клітини, ініціюють процес запалення [30]. Дефіцит ФХ стимулює процес апоптозу [32]. Отже, зміни активності фосфоліпази А2 (інгібування або гіперстимуляція) відіграють вирішальну роль в ураженні мембранних фосфоліпідів нейронів центральної нервової системи [27].
Фосфатидилінозит також є важливим компонентом біологічних мембран майже всіх тварин і рослинних тканин. Особливо багато ФІ міститься в мозку ссавців. Фосфоінозитиди відіграють важливу роль у контролі мембранно-цитозольних процесів, мембранного транспорту медіаторів, забезпеченні внутрішньоядерних процесів, регуляції проникності мембран [25]. Гідроліз ФІ каталізує особлива фосфодіестераза типу ферменту фосфоліпази С. Ініціація активності цього ензиму опосередковується стимуляцією мускаринових холінорецепторів М1, М3 і М5 підтипів, нейромедіаторами, посиленням Са2+-залежних процесів [21, 34]. Гідроліз ФІ посилюється також Са2+-залежною фосфоліпазою А2.
Продуктами розщеплення ФІ є два ключових вторинних месенджери — діацилгліцерин та фосфоінозитол. Останній зумовлює підвищення внутрішньоклітинної концентрації Са2+ в різних органах і тканинах, а діацилгліцерин активує протеїнкіназу С, що блокує калієві канали, різні клітинні ферменти, а також вбудовується в мембрани і фосфорилює різні мембранні білки-мішені [2]. Під дією фосфоліпази С утворюється арахідонова кислота, що каталізується ферментом 5-ліпоксигеназою з утворенням високоактивних біологічних субстанцій — лейкотрієнів [8]. Таким чином, гіперактивація фосфатидилінозитного каскаду відіграє важливу роль в ураженні клітинних мембран та виникненні патологічних змін у нейронах головного мозку.
Фосфатидилетаноламін є головним ліпідним компонентом більшості біологічних мембран. Порушення процесу ФЕА відіграє роль у виникненні ексайтотоксичності, зумовленої активацією NMDA-глутаматних рецепторів [4].
Фосфатидилсерин відіграє важливу роль у процесах клітинної сигналізації та апоптозу. Він контролює також вивільнення ацетилхоліну, допаміну і норадреналіну [29], відіграє ключову роль у механізмах фагоцитозу нейронів мікроглією в разі їх ураження [24].
Сфінгомієлін також контролює важливі фізіологічні функції в клітинах центральної нервової системи. Неконтрольоване посилення катаболізму СМ може призвести до загибелі нейронів після гострої церебральної ішемії [38].
Проведений аналіз свідчить, що фосфоліпіди є важливими складовими клітинних мембран усіх ссавців. Водночас дисрегуляція метаболізму мембранних ФЛ може зумовлювати порушення структури й функції клітинних мембран, а відтак і загибель уражених нейронів при гострих і хронічних цереброваскулярних захворюваннях, травматичних ураженнях головного і спинного мозку тощо. Тому нормалізація і стабілізація фосфоліпідного складу клітинних мембран, відновлення їх функції є обґрунтованим і одним з найперспективніших напрямків нейропротекції при мозкових інсультах.
Обґрунтування доцільності використання комбінації Цераксону і Корвітину
Як уже зазначалось, дефіцит енергії й вичерпування запасів АТФ після розвитку гострого ішемічного інсульту зумовлює ендогенну активацію катаболічних ферментів фосфоліпаз А2, С, ліпоксигеназ, циклооксигеназ, що спричиняє гідроліз фосфоліпідів енергозалежних клітинних мембран до вільних жирних кислот, порушення їх цілісності — одного з універсальних механізмів загибелі нейронів ішемізованої тканини мозку. У цьому процесі ключову роль відіграють катаболізм головного мембранного фосфоліпіду— фосфатидилхоліну [30], а також нейротоксичність метаболітів іншого ФЛ — фосфатидилінозиту [36].
З огляду на наведені дані при виборі оптимальної комбінації нейропротекторів для лікування гострого ішемічного інсульту необхідно передбачати включення до терапевтичного комплексу лікарських засобів, що гальмують активацію фосфоліпази А2, С, ліпоксигенази, циклооксигенази, збільшують продукцію мембранних фосфоліпідів, відновлюють функцію нейрональних мембран. До таких препаратів можна зарахувати Цераксон (цитиколін, цитидиндифосфат (ЦДФ) — холін) виробництва компанії Ferrer International (Іспанія) і препарат Корвітин виробництва ЗАТ НВЦ «Борщагівський хіміко-фармацевтичний завод» (Україна).
Протекторна дія Цераксону ґрунтується на доведених механізмах дії препарату [40]: запобігає руйнуванню клітинних мембран, відновлює їх структурну цілісність, підсилює механізми нейропластичності за рахунок стимуляції синтезу фосфатидилхоліну; інгібує продукцію вільних радикалів, активує систему внутрішньоклітинного антиоксидантного захисту; зменшує надлишкове вивільнення з аксональних терміналей ексайтотоксинів, інгібує апоптоз нейронів при гострій церебральній ішемії.
Таким чином, нейропротекторна дія Цераксону (цитиколіну) ґрунтується на різних механізмах: ослабленні активності фосфоліпази А2, попередженні деградації мембранних фосфоліпідів, підвищенні рівня відновленого глутатіону, гальмуванні активності перекисного окислення ліпідів [15]. Вважають, що синтез 80 % фосфоліпідів центральної нервової системи можна контролювати за рахунок змін концентрації цитиколіну [40].
Водночас, за даними клініко-біохімічного дослідження, цитиколін по-різному впливає на відновлення рівня окремих мембранних фосфоліпідів у хворих із гострою церебральною ішемією: препарат значно відновлює рівень фосфатидилхоліну [22], сфінгомієліну і кардіоліпіну [42], проте не впливає на рівень фосфатидилінозиту і фосфатидилсерину [15]. Вміст іншого мембранного фосфоліпіду — фосфатидилеталонаміну і метаболіту ФІ — діацилгліцеролу також не змінюється [14].
Наведені дані дають підставу зробити висновок, що Цераксон (цитиколін) не впливає на гіперактивацію фосфоліпази С, яка контролює біотрансформацію фосфатидилінозиту, утворення його метаболітів (фосфоінозитолу, діацилгліцеролу), а також не діє на активність ензиму 5-ліпоксигенази, яка каталізує перетворення арахідонової кислоти ліпоксигеназним шляхом з утворенням високотоксичних біологічних субстанцій — лейкотрієнів. Вони підвищують активацію вільнорадикальних процесів, протеолітичних і проапоптозних ферментів (каспаз) [20]. До того ж лейкотрієни стимулюють активність ферменту циклооксигенази-2, що призводить до збільшення продукції простагландинів, тромбоксану А2 (рис. 2).
Таким чином, монотерапія з використанням Цераксону (цитиколіну) у лікуванні гострого ішемічного інсульту не знижує активності ферментів фосфоліпази С, ліпоксигенази, протеїнкінази С, що повною мірою не може забезпечити цілісність поверхні біомембрани й регенерацію ураженої клітинної поверхні. Тому для підвищення ефективності лікування гострого ішемічного інсульту, досягнення синергічності впливу на взаємозв’язані патобіохімічні та молекулярні процеси обґрунтованим можна вважати комплексне використання нейропротекторів Цераксону в поєднанні з Корвітином.
Мішені терапевтичного впливу Корвітину при ішемічному інсульті різні: гальмування активності та експресії катаболічних прооксидантних і протеолітичних ферментів; інгібіція ліпоксигеназного шляху метаболізму арахідонової кислоти та синтезу лейкотрієнів; регуляція (пригнічення/стимуляція) активності ферментів фосфоліпази С, протеїнкінази С; попередження біотрансформації фосфатидилінозиту, часткове відновлення його рівня; вплив на процеси перекисного окиснення ліпідів, гальмування продукції вільних радикалів кисню, підвищення системи антиоксидантного захисту нейронів [7, 10, 5, 35].
Вплив нейропротекторів Цераксону й Корвітину на мембранні фосфоліпіди та взаємодія їх із цитозольними фосфоліпазами А2 і С при комплексному використанні у лікуванні гострого ішемічного інсульту схематично зображений на рис. 3.
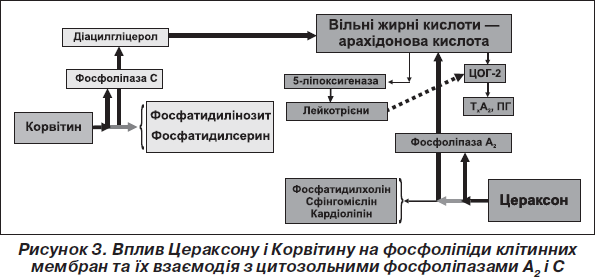
Як свідчать наведені на рис. 3 дані, Цераксон і Корвітин зумовлюють вплив на різні ферментні системи: інгібують відповідно фосфоліпазу А2 і С, тобто здійснюють непряму синергічну дію. Важливим є той факт, що дані ней-ропротектори знижують уміст цитозольних фосфоліпаз, водночас не викликають значного пригнічення функції цих та інших життєво важливих ферментів. Крім того, екзогенно введений при гострому ішемічному інсульті Цераксон стимулює синтез фосфатидилхоліну, сфінгомієліну, кардіоліпіну, а Корвітин підтримує безперервний синтез нових молекул фосфоліпідів фосфатидилінозиту, фосфатидилсерину. Такі фармакологічні властивості препаратів підтримують цілісність клітинних мембран нейронів, а відтак повинні забезпечити сумацію ефектів кожного з компонентів, кінцевий ефект комбінації лікарських препаратів.
Наведені нейропротекторні ефекти Цераксону й Корвітину обґрунтовують доцільність комплексного їх використання в лікуванні хворих на гострий ішемічний інсульт.
Мета дослідження: вивчення доцільності та клінічної ефективності комплексного застосування нейропротекторів Цераксону й Корвітину порівняно з монотерапією цих препаратів у лікуванні хворих із гострим ішемічним інсультом.
Об’єкт і методи дослідження
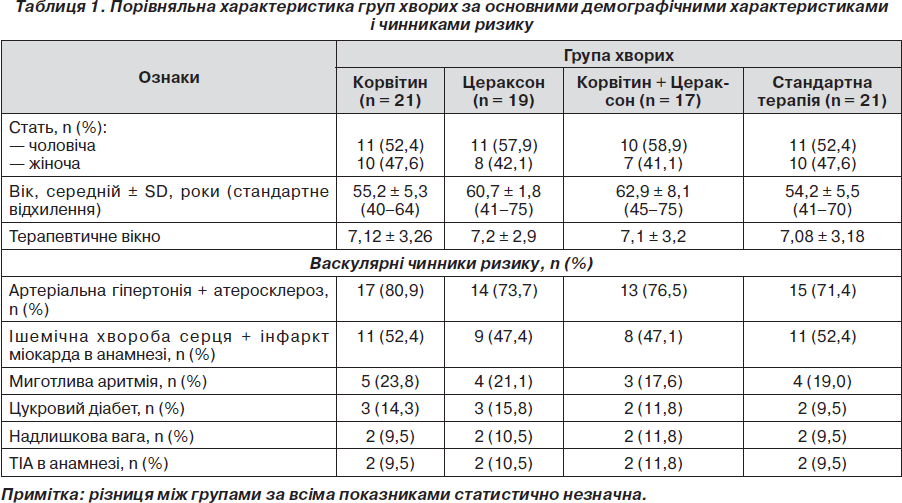
Проведено клініко-неврологічне обстеження 78 хворих із гострим ішемічним інсультом (43 чоловіки і 35 жінок) віком від 40 до 75 років (середній вік — 58,3 ± 10,3 року). Діагноз гострого ішемічного інсульту встановлювали за даними неврологічної клініки, комп’ютерної томографії (КТ), а також магнітно-резонансної томографії (МРТ) у стандартних Т1-, Т2-режимах. Основною причиною захворювання у 59 пацієнтів була артеріальна гіпертензія в поєднанні з атеросклерозом судин або цукровим діабетом. Залежно від застосованої терапії хворих на ішемічний інсульт розподілили на чотири групи.
1-шу групу становив 21 пацієнт віком від 40 до 64 років (середній вік — 55,2 ± 5,3 року), яким призначали Корвітин за такою схемою: початкову дозу 0,5 г вводили зразу після рандомізації; введення повторювали через 2 і 12 год; у період з 2-ї до 10-ї доби препарат призначали у дозі 0,5 г двічі на добу з інтервалом 12 год; вміст 1 флакону — 0,5 г розчиняли у 50 мл фізіологічного розчину хлориду натрію і вводили внутрішньовенно краплинно протягом 15–20 хв.
2-гу групу становили 19 пацієнтів віком від 41 до 75 років (середній вік — 60,7 ± 1,8 року), які отримували Цераксон по 1000 мг в 200 мл фізіологічного розчину хлориду натрію внутрішньовенно краплинно 1 раз на добу протягом 10 діб.
До 3-ї групи увійшли 17 пацієнтів віком від 45 до 75 років (середній вік — 62,9 ± 8,1 року), які отримували Корвітин у поєднанні з Цераксоном внутрішньовенно краплинно протягом 10 діб. Препарати вводили з інтервалом 6 год.
До 4-ї (контрольної) групи включили 21 пацієнта віком від 41 до 70 років (середній вік — 52,4 ± 5,5 року), яким призначали стандартну терапію, вона включала: пентоксифілін— 5 мл внутрішньовенно краплинно, ацетилсаліцилову кислоту — 325 мг перорально в перші 2 доби, а потім по 100 мг/добу, інгібітори АПФ (еналаприл 5–10 мг/добу), b-адреноблокатори (бісопролол 5 мг/добу). Хворі досліджуваних груп не отримували тромболітичну терапію, їм не призначали інші нейропротектори, антиоксиданти.
Між групами хворих, які приймали Корвітин, Цераксон, їх комбінацію та стандартну терапію, не виявлено статистично значимої різниці за основними демографічними параметрами, васкулярними чинниками ризику розвитку інсульту (табл. 1). Досліджувані групи суттєво не розрізнялись за часовим періодом від перших проявів інсульту до початку терапії.
Критеріями включення пацієнтів до груп були вік > 18 років; дані нейровізуалізації, що підтверджували діагноз ішемічного інсульту; згідно з рекомендаціями Академічно-промислового круглого стола стосовно терапії інсульту STAIR II (Stroke Therapy Round-table II) до дослідження залучали пацієнтів з інсультом середньої тяжкості, з рівнем неврологічного дефіциту 9–15 балів за шкалою NIHSS; виключали з груп випробування пацієнтів з лакунарним інфарктом, інфарктом мозочка.
Неврологічне обстеження проводили при рандомізації, на 6-ту та 11-ту добу (після парентерального введення препаратів), після закінчення лікування у клініці на 21-й день, а також на 90-ту добу. Обстеження включало оцінку суб’єктивних даних, неврологічного статусу за такими шкалами: Шкала тяжкості інсульту Національного інституту здоров’я США (National Institute of Health Stroke Scale); модифікована шкала Ренкіна для оцінки функціональної незалежності, ступеня інвалідності; індекс Бартел для характеристики загальної функціональної незалежності. Для визначення показника повного відновлення неврологічних функцій через 3 міс. застосовували також глобальний тест з урахуванням комбінації показників згідно з NIHSS, мШР, ІБ.
Первинною кінцевою точкою оцінки ефективності монотерапії Корвітином, Цераксоном та їх поєднання порівняно зі стандартною терапією був показник повного відновлення неврологічних функцій за даними глобального тесту: NIHSS ≤ 1 бала, мШР ≤ 1 бала, ІБ ≥ 95 балів. Високою ефективністю вважали зменшення неврологічного дефіциту за шкалою NIHSS > 4 балів і відновлення життєдіяльності за мШР > 4 балів. Критерієм сприятливого результату лікування вважали досягнення на тлі терапії за мШР 0–2 балів, несприятливого завершення — 3–5 балів або смерть. Відмінність результатів лікування хворих у групах порівняння вважали суттєвою в разі досягнення різниці показника повного відновлення неврологічних функцій за ГТ на ≥ 10 % [37].
Статистична обробка даних включала використання стандартних методик оцінки відмінності в порівнюваних групах за допомогою параметричних тестів із використанням програм Microsoft Excel 2003, SPSS, GEE. З метою перевірки гіпотези про різницю між групами хворих використовували критерій Вілкоксона, U-критерій Манна— Уїтні, t-критерій Стьюдента. Статистично вірогідною вважали різницю р < 0,05.
Результати та їх обговорення
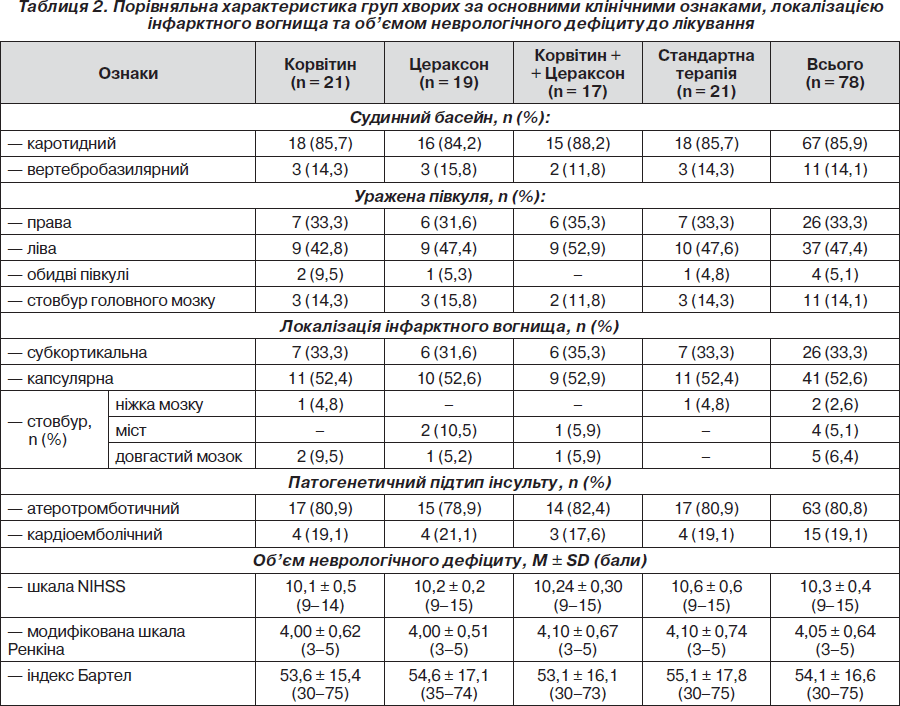
У переважної більшості хворих досліджуваних груп (у 67) вогнище ішемії локалізувалось у каротидному басейні, в 11 — у судинах вертебробазилярного басейну. За патогенетичним механізмом розвитку переважали ішемічні інсульти атеротромботичного підтипу (у 63), кардіоемболічний виявлявся у 15 пацієнтів. Початковий рівень неврологічного дефіциту за шкалою NIHSS у середньому відповідав інсульту середньої тяжкості. Отже, клінічні групи були порівнянні за локалізацією інфарктного вогнища, патогенетичним під-типом і вираженістю неврологічного дефіциту (табл. 2).
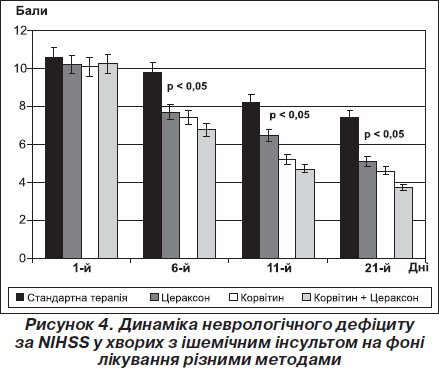
Результати аналізу динаміки середнього клінічного бала за шкалою NIHSS свідчать, що на фоні нейропротекторної монотерапії Корвітином, Цераксоном і комплексної нейропротекції ішемічного інсульту з використанням Корвітину і Цераксону статистично значимий (р < 0,05) згідно з критерієм Вілкоксона регрес наставав на 6-ту добу в усіх трьох групах (рис. 4). На 11-ту добу лікування (завершення парентерального введення нейропротекторних засобів) у всіх трьох групах — Корвітину, Цераксону і особливо комплексу засобів «Корвітин + Цераксон» спостерігалося вірогідне прискорення відновлення неврологічних функцій щодо початкового рівня (р < 0,001) і порівняно з групою стандартної терапії. Така тенденція зберігалась і на 21-шу добу спостереження, а відновлення неврологічних функцій у цей період було ефективнішим на тлі комплексного використання Корвітину і Цераксону порівняно з монотерапією цих препаратів (р < 0,001). На фоні стандартної терапії вірогідний регрес неврологічних розладів порівняно з початковим рівнем наставав лише на 11-ту добу лікування (рис. 4).
Оцінка результатів нейропротекторної моно- та комбінованої терапії з використанням Корвітину і Цераксону за мШР показала, що на 21-й день лікування хороший неврологічний/функціональний результат (0–2 бали) був відповідно у 80,9, 78,9 і 82,4 %. У групі стандартної терапії на 21-шу добу спостереження переважали пацієнти з функціональною неспроможністю, оскільки в 66,7 % випадків показник за мШР був у діапазоні 3–5 балів.
Порівняння терапевтичної ефективності різних методів лікування хворих за NIHSS і мШР також показало, що ефективнішим було застосування монотерапії Корвітином і Цераксоном, а також їх комплексне використання: високої ефективності на 21-шу добу досягнуто відповідно у 76,2; 78,9 і 82,3 %, на 90-ту добу — у 84,9, 84,2 і 88,2 %. У групі стандартної терапії високу ефективність на 21-шу добу визначали у 33,3 %, на 90-ту добу — у 42,9 % пацієнтів. Рівень ранньої смертності (перші 14 діб) становив відповідно 4,8; 5,3; 5,9 і 9,5 %.
Таким чином, використання нейропротекторів Корвітину і Цераксону як монотерапії та двокомпонентної комбінації цих препаратів за обсягом відновлення неврологічних функцій було ефективнішим порівняно зі стандартною терапією на 21-шу і 90-ту добу спостереження (р < 0,01).
Більш інформативну оцінку щодо комплексного використання Корвітину і Цераксону в лікуванні гострого ішемічного інсульту ми отримали при розрахунку загального показника відновлення неврологічних функцій (неврологічного одужання), вираженого комбінацією параметрів за NIHSS, мШР та ІБ через 3 міс. спостереження. Повне одужання було досягнуте у 41,2 % пацієнтів, які лікувались Корвітином у поєднанні з Цераксоном, у 26,8 % — Корвітином, у 29,6 % — Цераксоном і у 23,8 % — стандартною терапією.
Статистична різниця показників повного відновлення неврологічних функцій за глобальним тестом між пацієнтами клінічної групи комбінованої терапії «Корвітин + Цераксон» і групами монотерапії із застосуванням Корвітину й Цераксону (цитиколіну) становила відповідно 14,4 і 11,6 % (р < 0,05), а з групою стандартної терапії — 17,4 % (р < 0,001), тобто була суттєвою.
Отже, комплексна нейропротекція з одночасним використанням Корвітину й Цераксону істотно підвищувала ефективність терапії гострого ішемічного інсульту за рахунок синергічної та поєднаної дії застосованих лікарських засобів, що забезпечувало суттєве збільшення показника повного відновлення неврологічних функцій. Оскільки потенційні мішені терапевтичної атаки Корвітину і Цераксону на прояви ішемічного і запального каскаду різні, застосовані препарати здійснювали непряму синергічну дію. Фармакодинамічні властивості компонентів комплексної нейропротекції зумовлювали сумацію терапевтичних ефектів кожного зі складових комбінованої нейропротекції. Тому терапевтична ефективність комбінації лікарських засобів була більш вираженою, ніж для кожного з компонентів. Нейропротекторні засоби Корвітин і Цераксон безпечні, їх переносимість подібна до засобів нейропротекторної терапії.
Висновки
Комбінована нейропротекція з використанням Корвітину (кверцетину) і Цераксону (цитиколіну) істотно підвищувала ефективність лікування гострого ішемічного інсульту порівняно з монотерапією цих засобів за рахунок непрямої синергічної дії застосованих препаратів, що зумовлювало сумацію терапевтичних ефектів кожного з компонентів комплексної нейропротекції.
Використання комплексної нейропротекції Корвітином із послідовним застосуванням Цераксону в перші 10 діб після розвитку симптомів у пацієнтів із гострим середньотяжким ішемічним інсультом суттєво збільшує вірогідність повного відновлення неврологічних функцій порівняно з мононейропротекцією Корвітином і Цераксоном на 90-й день спостереження.
Результати клінічного та статистичного аналізу свідчать про безумовну перевагу комбінованої нейропротекції з використанням Корвітину й Цераксону порівняно з монопротекцією цих препаратів, а також суттєву перевагу мононейропротекції Корвітином і Цераксоном порівняно зі стандартною терапією гострого ішемічного інсульту.