Некоторые клинико-патогенетические характеристики первого и повторного мозговых инсультов |
|
|
Проблема цереброваскулярной патологии является одной из наиболее актуальных проблем не только клинической неврологии, но и медицины вообще. По данным ВОЗ, ежегодно в мире регистрируется более 15 млн случаев инсульта, более половины из этих пациентов умирают в течение первого года, около 80% выживших остаются инвалидами [1, 3–5]. Причем актуальность проблемы обусловлена также и тем, что примерно в 25–30% случаев после первого мозгового инсульта в течение года развивается повторный [2, 5]. Следует отметить, что вопросы этиопатогенеза, а также клинико-патогенетической взаимосвязи между первым и повторным мозговыми инсультами изучены недостаточно. В частности, большой интерес представляет вопрос о взаимосвязи между патогенетическими типами первого и повторного ишемических мозговых инсультов. Как известно, ишемический мозговой инсульт по современным представлениям является неоднородным по своему патогенезу, и в этом отношении выделяют по крайней мере пять патогенетических типов ишемического инсульта (ИИ). Это лакунарный инсульт (Ли), атеротромботический (Атр) инсульт, кардиоэмболический (Кэ) инсульт, в том числе артерио-артериальная эмболия, гемодинамический (Гмд) и гемореологический (Гмр) варианты. В настоящее время на основании клинико-параклинической и патоморфологической верификации, выделены критерии диагностики патогенетических типов ишемического мозгового инсульта [2, 3].
Атеротромботический инсульт: а) начало — чаще прерывистое, ступенеобразное, с постепенным нарастанием симптоматики на протяжении часов или суток, часто дебютирует во время сна; б) наличие атеросклеротического поражения экстра- и/или интракраниальных артерий (выраженный стенозирующий, окклюзирующий процесс, атеросклеротическая бляшка с неровной поверхностью, с прилежащим тромбом) соответственно очаговому поражению головного мозга; в) часто предшествуют ипсилатеральные транзиторные ишемические атаки; г) размер очага поражения может варьировать от малого до обширного.
Кардиоэмболический инсульт: а) начало — как правило, внезапное, появление неврологической симптоматики у бодрствующего, активного пациента, неврологический дефицит максимально выражен в дебюте заболевания; б) локализация — преимущественно зона васкуляризации средней мозговой артерии, инфаркт— чаще средний или большой, корково-подкорковый; в) характерно наличие геморрагического компонента (по данным КТ); г) анамнестические указания и КТ-признаки множественного очагового поражения мозга (в том числе «немые» инфаркты) в различных бассейнах, не являющихся зонами смежного кровоснабжения; д) наличие кардиальной патологии — источника эмболии; е) отсутствие грубого атеросклеротического поражения сосуда проксимально по отношению к закупорке интракраниальной артерии, симптом «исчезающей окклюзии» при динамическом ангиографическом обследовании; ж) в анамнезе возможны указания на тромбоэмболии других органов.
Гемодинамический инсульт: а) начало — внезапное или ступенеобразное, как у активно действующего пациента, так и у находящегося в покое; б) локализация очага — зона смежного кровоснабжения, в том числе корковые инфаркты, очаги в перивентрикулярном и белом веществе семиовальных центров, размер инфаркта — от малого до большого; в) наличие патологии экстра- и/или интракраниальных артерий: атеросклеротическое поражение (множественное, комбинированное, эшелонированный стеноз), деформации артерий (угловые изгибы, петлеобразование), аномалии сосудистой системы мозга (разобщение виллизиева круга, гипоплазии артерий); г) гемодинамический фактор: снижение АД (физиологическое — во время сна, а также ортостатическая, ятрогенная артериальная гипотензия, гиповолемия), падение минутного объема сердца (уменьшение ударного объема сердца вследствие ишемии миокарда, значительное урежение ЧСС).
Лакунарный инсульт: а) предшествующая артери-альная гипертензия; б) начало — чаще интермиттирующее, симптоматика нарастает в течение часов или дня, АД обычно повышено; в) локализация инфаркта— подкорковые ядра, прилежащее белое вещество семиовального центра, внутренняя капсула, основание моста мозга, размер очага — малый, до 1–1,5 см в диаметре, может не визуализироваться при КТ головы; г) наличие характерных неврологических синдромов (чисто двигательный, чисто чувствительный лакунарный синдром, атактический гемипарез, дизартрия и монопарез; изолированный монопарез руки, ноги, лицевой и другие синдромы), отсутствие общемозговых и менингеальных симптомов, а также нарушений высших корковых функций при локализации в доминантном полушарии, течение — часто по типу малого инсульта.
Гемореологический инсульт: а) минимальная выраженность сосудистого заболевания (атеросклероз, артериальная гипертензия, васкулит, васкулопатия); б) наличие выраженных гемореологических изменений, нарушений в системе гемостаза и фибринолиза; в) выраженная диссоциация между клинической картиной (умеренный неврологический дефицит, небольшой размер очага) и значительными гемореологическими нарушениями.
Клинический опыт показывает, что не всегда патогенетический тип первого инсульта совпадает с патогенетическими типами повторного ишемического инсульта (ПИИ) [2]. Однако на достаточно большом клиническом материале эти вопросы плохо изучены. Кроме того, представляют интерес вопросы о сосудистом бассейне, а также полушарной латерализации первого и повторного ишемических инсультов, о клинической трансформации ишемического и геморрагического первого и повторного мозговых инсультов.
Учитывая вышеизложенное, мы провели проспективное и ретроспективное исследование 81 случая повторного мозгового инсульта (63 больных с первым ишемическим и 18 с первым геморрагическим инсультом (ГИ)) с детальной клинико-патогенетической оценкой каждого случая. При этом на основании вышеуказанных критериев были проанализированы патогенетические типы первого и повторного инсультов при ишемическом их варианте. Верификация патогенетических типов ишемического инсульта проводилась клинически и с использованием обширного арсенала инструментально-лабораторных методов исследования (КТ, ангиография, ультразвуковая допплерография мозговых сосудов, ЭКГ и Эхо-КГ, коагулологические исследования крови и др.).
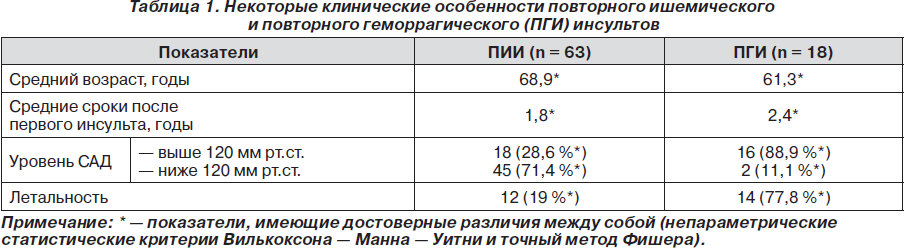
Полученные результаты представлены в табл. 1, а также в наглядном виде на рис. 1–3.
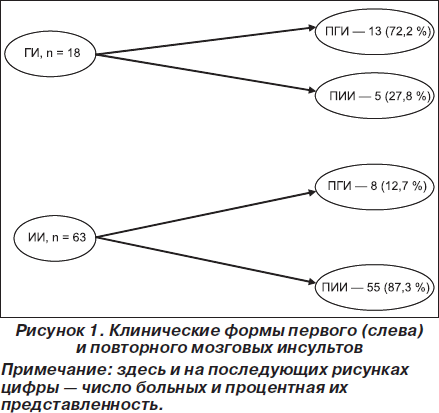
Как видно из рис. 1, при геморрагических инсультах по сравнению с ишемическими (ИИ) повторные инсульты относительно реже развиваются по тому же геморрагическому типу (72,2 % случаев), тогда как при ишемическом инсульте повторный инсульт относительно чаще также бывает ишемическим (в 87,3 % случаев). Другими словами при ИИ сравнительно чаще развивается ПИИ, чем при ГИ — ПГИ. Это означает, что факторы риска развития ИИ более стабильны, чем аналогичные при ГИ. Интересно отметить, что у всех 5 больных, у которых после ранее перенесенного ГИ развился ПИИ, последний по своим клинико-патогенетическим и нейровизуализационным характеристикам был лакунарным. Представляет интерес также тот факт, что у 8 больных, перенесших ПГИ после ИИ, очаг геморрагии имел локализацию в другом полушарии.
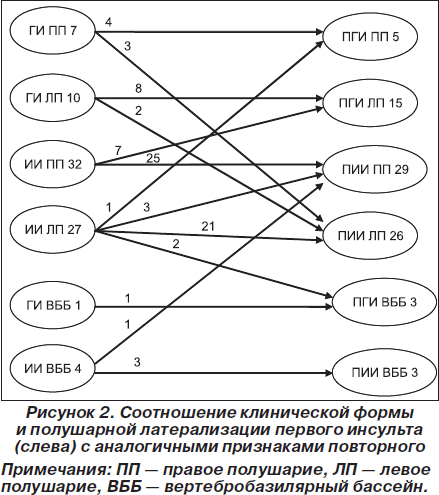
Интересные данные были получены нами при анализе клинической трансформации первого и повторного ИИ и ГИ с учетом полушарной латерализации патологического процесса. Эти данные представлены на рис. 2.
Как видно из рис. 2, правополушарный ГИ в 57% случаев трансформировался в аналогичный повторный правополушарный ПГИ и в 43 % случаях — в повторный левополушарный ПИИ. Левополушарный ГИ в 80 % случаях трансформировался в аналогичный левополушарный ПГИ и в 20 % случаях — в левополушарный ПИИ. Правополушарный ИИ в 78 % случаях трансформировался в правополушарный ПИИ и в 22% случаях — в левополушарный ПГИ. Более полиморфной оказалась трансформация левополушарного ИИ. В 78% случаев он трансформировался в левополушарный ПИИ. В остальных случаях наблюдалась разнообразная по клинической форме и латерализации процесса трансформация (правополушарный ПГИ, правополушарный ПИИ и инсульт в ВББ). Достаточно стабильной оказалась трансформация редкого варианта ГИ в ВББ. Нами наблюдался всего 1 такой случай. Это было небольшое кровоизлияние в варолиев мост, и при ПГИ той же локализации больной скончался. И наконец, ИИ в ВББ в большинстве случаев — 75 % — трансформировался в ПИИ в ВББ и в 25 % — в ПГИ в каротидном бассейне правого полушария.
Таким образом, результаты данной части исследования свидетельствуют о том, что в целом в большинстве случаев повторный инсульт развивается в том же полушарии. Однако имеются некоторые особенности клинической трансформации разновидности инсультов. В частности при повторном инсульте можно отметить тенденцию к латерализации процесса в противоположном полушарии по отношению к первичному очагу в случае трансформации ГИ в ПИИ.
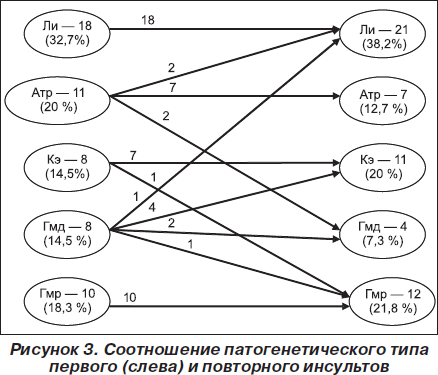
Достаточно интересные результаты получены нами при анализе клинической трансформации при ПИИ с учетом патогенетического типа первого инсульта. Эти данные представлены на рис. 3. Из данной части анализа были исключены 5 пациентов с первоначальным ишемическим инсультом, у которых впоследствии развился ПГИ. Как видно из рис. 3, наиболее стабильными в отношении клинической трансформации повторного инсульта оказались характеристики Ли. В 100 % случаев повторный инсульт оказался также лакунарным. То же самое можно сказать в отношении Гмр варианта. Повторный инсульт при первом Гмр варианте также оказался в 100 % случаев Гмр. Вместе с тем полиморфизм клинической трансформации повторного инсульта по отношению к первому выявлялся при Атр, Кэ и Гмд вариантах ИИ. В частности, наиболее полиморфным оказался в этом отношении Гмд вариант ишемического инсульта. Лишь в 2 случаях из 8 он также был Гмд при повторном инсульте.
Интересно то, что в 50 % случаев Гмд вариант трансформировался в Кэ вариант, что вызвано, на наш взгляд, тем, что в патогенезе Гмд варианта ИИ чаще всего играет роль сердечная недостаточность, которая обусловлена ишемической болезнью сердца и в большинстве случаев постинфарктным процессом с вероятной организацией пристеночного тромба в сердце. В небольшом проценте случаев Гмд вариант инсульта трансформировался в Гмр и Ли варианты. На втором месте по полиморфизму патогенетических типов повторного инсульта стоит Атр вариант. Лишь в 7 случаях из 11 Атр ИИ трансформировался при повторении острого нарушения мозгового кровообращения в Атр вариант и поровну при повторных случаях он трансформировался в Гмд и Ли варианты. Относительно стабильными оказались характеристики Кэ инсульта, в частности лишь в одном случае из 8 Кэ вариант при повторном инсульте трансформировался в Гмр, а в остальных случаях ПИИ носил тот же патогенетический вариант.
Таким образом, данная часть нашего исследования свидетельствует о том, что патогенетические механизмы, реализующие первичный и повторный мозговые инсульты, могут со временем трансформироваться. В частности, трансформация наиболее значима при таких вариантах ИИ, как Атр и Гмд, что следует учитывать при проведении мероприятий по вторичной профилактике инсультов.
В заключение следует отметить, что результаты нашего исследования, которые носят в целом предварительный характер, тем не менее позволяют уточнить некоторые клинические и этиопатогенетические аспекты повторных инсультов. В частности, представляют интерес данные о том, что ПИИ развивается после первого ИИ быстрее, чем ПГИ после первого ГИ. Существуют споры относительно уровня АД и риска повторного инсульта. По нашим данным, риск ПИИ выше при более низких цифрах АД, а риск ПГИ выше при более высоких цифрах. Представляет интерес выявленная тенденция, говорящая о том, что в случае ПИИ после первого ГИ и наоборот очаг повторного инсульта локализуется чаще в другом полушарии, а при отсутствии клинической трансформации инсульта (то есть ГИ — ПГИ и ИИ — ПИИ) очаг чаще имеет ту же полушарную латерализацию. Существует мнение о том, что ПИИ должен иметь тот же патогенетический тип, что и первый. Наше исследование показало, что такая точка зрения справедлива по отношению к Ли и Гмр типам. Что касается других типов ИИ, то, по нашим данным, повторный инсульт может «менять» свой патогенез. В этом отношении наименее стабильными оказались Гмд и Атр типы ИИ. Можно быть уверенными, что дальнейшие исследования в этом направлении с детальным анализом факторов риска первого и повторного инсультов помогут в решении вопросов прогнозирования повторных инсультов и улучшении результатов вторичной профилактики.
Литература1. Gusev E., Haab A., Schimrigk K. Guekht A. Russian-German stroke data bank: 3-year follow-up of the Russian part // Europ. J. Neurology. — 2000. — Vol. 7, Suppl. 3. — P. 21.2. Скворцова В.И., Чазова И.Е., Стаховская Л.В. Вторичная профилактика инсульта. — М.: ПАГРИ, 2002. — 118 с.3. Инсульт: диагностика, лечение, профилактика / Под ред. З.А. Суслиной, М.А. Пирадова. — М.: МЕДпресс-информ, 2009. — 288 с.4. Тул Д.Ф. Сосудистые заболевания головного мозга. — М.: ГЭОТАР-Медиа, 2007. — 590 с.5. Hankey G.J. Stroke. — Churchill Livingstone, 2002. — 359 p.