Новые возможности в патогенетической терапии хронической ишемии головного мозга |
|
|
Сосудистая патология головного мозга остается одной из важнейших проблем клинической медицины в связи с большой распространенностью сосудистых заболеваний мозга, высокой смертностью вследствие острых нарушений мозгового кровообращения и тяжелой, стойкой инвалидизацией, наступающей у больных [1–6].
Значительное место в структуре сосудистых заболеваний головного мозга занимают хронические нарушения мозгового кровообращения, обозначаемые нами в отечественной литературе и клинической практике термином «дисциркуляторная энцефалопатия». Дисциркуляторная энцефалопатия представляет собой результат «медленно прогрессирующей недостаточности кровоснабжения, приводящей к развитию множественных мелкоочаговых некрозов мозговой ткани и обусловливающей нарастающее нарушение функций головного мозга».
В структуре цереброваскулярных заболеваний эта патология занимает около 90 % [4–6]. Ведущими причинами увеличения количества больных с дисциркуляторной энцефалопатией в стране являются рост распространенности в популяции артериальной гипертензии (АГ), атеросклероза, сахарного диабета, болезней сердца и др. [5–9].
В основе патогенетических механизмов дисциркуляторной энцефалопатии, обусловленной АГ или атеросклерозом, лежат нарушения церебральной и общей гемодинамики, метаболизма мозга, реологических свойств крови. При АГ и атеросклерозе происходят изменения в стенке экстра- и интракраниальных сосудов, в микроциркуляторном русле, приводящие к гипоксии и ишемии мозговой ткани [10, 11]. Морфологические изменения в сосудах характеризуются гипертрофией мышечной оболочки сосуда, гиперэластозом, плазмо- и геморрагиями в стенке артерии, некрозом миоцитов идр. Изменения сосудов начинаются как адаптивные, в последующем носят патологический характер, усугубляя существующую недостаточность кровоснабжения мозга, приводя к острым и хроническим нарушениям мозгового кровообращения [12–14]. Патоморфологической основой дисциркуляторной энцефалопатии являются множественные зоны ишемии мозга, его подкорковых отделов, сопровождающиеся персистирующим отеком, деструкцией миелиновых волокон, атрофическими изменениями.
Ведущим патофизиологическим механизмом хронической ишемии головного мозга является гипоксия, которая влечет за собой по принципу порочного круга увеличение РаСО2, тканевый ацидоз, блокаду натриевого насоса, вазодилатацию, замедление артериального кровотока, затруднение ликвороциркуляции и венозного оттока из полости черепа [15–17].
В общей проблеме сосудистой патологии мозга значительное место занимает внутричерепная венозная гипертензия. Постепенно в ангионеврологии утверждается концепция венозной дисфункции в формировании цереброваскулярной патологии. Клиническая картина различных форм хронической церебральной ишемии — дисциркуляторной энцефалопатии — зачастую определяется не только нарушениями в артериальной системе головного мозга, но и в значительной мере расстройствами венозного кровообращения, причем в этих случаях течение и исход болезни зачастую зависят именно от венозных нарушений [18–22]. Указанные авторы настаивали на необходимости всестороннего расширения и углубления знаний обо всех звеньях цереброваскулярных расстройств, признании терминов «венозная дисгемия», «венозная дисциркуляторная энцефалопатия».
До недавнего времени изучение венозного компонента мозгового кровообращения значительно отставало по своему объему от исследований артериальной гемодинамики. Вместе с тем у 71,5 % больных с артериальной гипертензией методом УЗИ обнаружена компрессия внутренних яремных, брахиоцефальных, позвоночных вен, а у ряда больных — веногипотония, недостаточность клапанов в устьях вен и аномалии их строения. По данным МР-венографии, у больных с тяжелой и злокачественной АГ признаки нарушения венозного оттока головного мозга встречаются в 91 % случаев, а у больных с АГ 1–2-й стадии — в 55 % случаев.
В последние годы становится очевидным, что при нарушениях мозгового кровообращения наиболее важную патогенетическую роль играют два фактора: 1)недостаточность притока крови к тканям мозга в бассейне стенозированной или закупоренной артерии; 2) недостаточность или задержка венозного оттока. Эти два процесса тесно взаимосвязаны, так как при нарушениях кровообращения в артериях мозга в той или иной степени страдает венозный отток; равным образом патология вен мозга приводит к нарушению артериальной гемодинамики и метаболизма мозга [18–23]. В настоящее время венозную систему мозга рассматривают как высокоорганизованную рефлексогенную зону, ответственную за развитие сложных, имеющих большое физиологическое значение компенсаторных реакций, обеспечивающих постоянство мозгового кровотока.
Венозный застой в головном мозге является наиболее частой формой расстройств венозного мозгового кровообращения. При нарастании венозного застоя наступают значительные изменения мозгового метаболизма, нарушается кислородный, водный, углеводный, жировой баланс мозга, нарастают гипоксия и гиперкапния, повышается венозное и внутричерепное давление, развивается отек мозга. Показана высокая степень зависимости дисциркуляторной энцефалопатии от венозного застоя, который у этих больных носит тотальный (по типу общей флебопатии) характер. Это выдвигает проблему борьбы с ликворно-венозными нарушениями у больных с дисциркуляторной энцефалопатией в число приоритетных и определяет актуальность поиска терапевтических воздействий, направленных на снижение венозного давления в мозге.
В лечении больных с нарушениями венозной мозговой гемоциркуляции значительное место занимает медикаментозная терапия, направленная на обеспечение интракраниального венозного оттока [24–26]. К сожалению, вопросы фармакотерапии расстройств венозного мозгового кровообращения до сих пор остаются спорными и недостаточно отработанными. Спектр действия большинства препаратов достаточно узок (декстраны влияют на реологию крови, антиагреганты уменьшают агрегационную активность тромбоцитов, венотоники улучшают тонус венозной стенки), и для достижения оптимального эффекта необходимо применять несколько препаратов разных групп. Сегодня идет поиск идеального препарата для лечения расстройств венозного мозгового кровообращения, который должен воздействовать на как можно большее количество патогенетических звеньев, иметь минимальное количество побочных эффектов и высокую биодоступность.
Сегодня на фармакологическом рынке присутствует препарат L-лизина эсцинат®, 0,1% раствор для инъекций (корпорация «Артериум», Украина), действующим веществом которого является водорастворимая соль сапонина конского каштана— эсцина и аминокислоты L-лизина. В препарате содержание b-эсцина составляет 76,35–79,29%. Препарат обладает венотоническим, противоотечным действием, уменьшает явления венозного застоя и нарушения трофики ткани благодаря нормализации микроциркуляции, сосудистой и тканевой проницаемости.
Проведено достаточное количество различных многоцентровых исследований, которые показали эффективность L-лизина эсцината® при лечении больных в нейрохирургии, неврологии, вертебрологии, ревматологии, травматологии [27–31].
Показано, что терапия L-лизина эсцинатом® приводит к уменьшению воспалительных, болевых проявлений, тяжести, отеков, оказывает умеренный иммунокорригирующий и гипогликемический эффекты. Эффективность препарата доказана при тяжелых отеках головного и спинного мозга, в том числе при травматических поражениях, субарахноидальных кровоизлияниях и внутричерепных гематомах со смещением срединных структур головного мозга и с явлениями отека-набухания; при отечно-болевых, отечно-воспалительных синдромах позвоночника, туловища, конечностей; тяжелых нарушениях венозного кровообращения нижних конечностей при остром тромбофлебите.
Препарат оказывает действие на основные звенья формирования венозной дисциркуляторной патологии (центральные, гемодинамические, циркуляторные).
Исходя из приведенных выше данных, нами предпринято исследование по изучению эффективности препарата L-лизина эсцинат®, 0,1% раствор для инъекций (корпорация «Артериум», Украина), в комплексной терапии пациентов с ликворно-венозными нарушениями при хронической ишемии мозга.
Основные задачи исследования:
1. Оценить эффективность исследуемого препарата в лечении ликворно-венозных нарушений у больных с хронической ишемией мозга (дисциркуляторной энцефалопатией).
2. Изучить венотропный эффект исследуемого препарата, его влияние на венозный кровоток и гемодинамику в лечении больных с хронической ишемией мозга.
3. Оценить превышающую терапевтическую эффективность исследуемого препарата по сравнению с группой контроля на основании результатов лечения, полученных в основной и контрольной группах.
Всем больным проводили полное клинико-инструментальное обследование.
Основными методами обследования были:
1. Объективный осмотр (измерение артериального давления (АД), частоты сердечных сокращений, проведение ЭКГ, измерение температуры (t) тела, аускультация сердца, легких, оценка субъективных жалоб).
2. Клинико-неврологическое обследование. Оценивали выраженность следующих симптомов: головная боль, шум в голове, шаткость при ходьбе, колебания артериального давления, цианоз кожных покровов лица, отечность под глазами, утренняя отечность лица, расширение вен кожи лица, зрительные нарушения, нарушения сна, утомляемость, снижение работоспособности. Оценка клинико-неврологических показателей проводилась с использованием вербальной аналоговой шкалы в баллах: 0 — признак отсутствует; 1 — признак выражен слабо; 2 — признак выражен умеренно; 3 — признак выражен сильно.
3. Нейропсихологическое обследование (определение состояния пациента по шкале астенического состояния (ШАС)). Шкала астенического состояния разработана Л.Д. Майковой и адаптирована Т.Г. Чертовой на базе данных клинико-психологических наблюдений и известного опросника MMPI (Миннесотский многомерный личностный перечень). Шкала состоит из 30 пунктов-утверждений, отражающих характеристики астенического состояния. Оценка астенического состояния по ШАС проводилась согласно градации: от 30 до 50 баллов — отсутствие астении; от 51 до 75 баллов — слабая астения; от 76 до 100 баллов — умеренная астения; от 101 до 120 баллов — выраженная астения.
4. Транскраниальное дуплексное сканирование (ТКД) интракраниального венозного кровотока с оценкой скоростных параметров в венах Розенталя. ТКД проводили на аппарате Sci med производства фирмы Medata (Швеция) по методике В.Г. Лелюк, С.Э. Лелюк (2003). Повышение усредненной по времени максимальной скорости кровотока (ТАМАХ) в венах Розенталя более 15 см/с расценивали как проявление внутричерепной гипертензии и нарушения венозной циркуляции.
5. Регистрация спонтанной пульсации церебрального участка ретинальной вены. Осуществлялась визуально методом прямой офтальмоскопии электрическим офтальмоскопом ОР-2 в затемненном помещении после предварительного расширения зрачка. О наличии пульсации судили по спонтанному изменению диаметра вены в пределах диска зрительного нерва.
Нами было обследовано 56 пациентов обоих полов в возрасте от 35 до 59 лет с диагнозом «хроническая ишемия мозга (дисциркуляторная энцефалопатия 1–2-й стадии) с ликворно-венозными нарушениями» и выраженностью астении по ШАС 76–95 баллов, что соответствовало астении средней степени выраженности.
Все испытуемые методом простой рандомизации были распределены на две группы: основную (25 человек) и контрольную (31 человек).
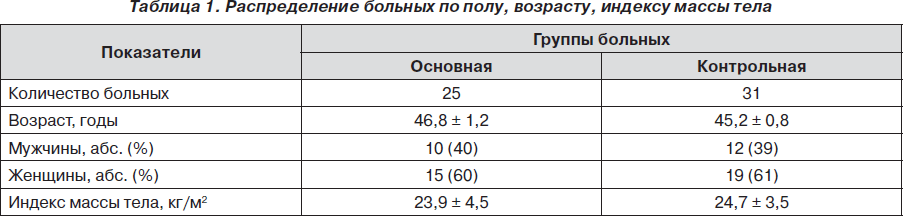
В табл. 1 приведено распределение пациентов по полу, возрасту, индексу массы тела.
Как видно из табл. 1, группы были однородными по полу, возрасту, индексу массы тела с равным преобладанием женщин в каждой группе.
Все пациенты получали базисную терапию (согласно стандартам лечения больных с хронической ишемией мозга (дисциркуляторной энцефалопатией)), включающую гипотензивные, гиполипидемические средства, антиагреганты (дозы которых были уменьшены в связи с возможностью усиления эффекта при совместном применении с L-лизина эсцинатом®), при необходимости — седативные препараты, а также физиотерапевтические процедуры.
Пациенты основной группы наряду с базисной терапией ежедневно на протяжении 10 дней (1 раз в день в первой половине дня) получали исследуемый препарат L-лизина эсцинат®, 0,1% раствор, по 10 мл внутривенно капельно в 50 мл физиологического раствора.
Положительными результатами терапии считали: устранение симптомов болезни или снижение выраженности симптомов до 1 балла; хорошую переносимость препарата; отсутствие побочных реакций.
Критериями эффективности препарата были: нормализация клинико-неврологического статуса, показателей ТКД, офтальмоскопии; переход на более чем один уровень вниз по ШАС или уменьшение суммы баллов по ШАС более чем на 25 баллов в конце 10-дневного курса приема препарата.
Статистическую обработку полученных данных проводили с использованием методов описательной статистики (для количественных показателей — n, среднее арифметическое, медиана, стандартное отклонение, минимальное и максимальное значения; для качественных показателей— частота и доля в процентах), критериев Фишера — Стьюдента, хи-квадрат Пирсона, Шапиро — Уилка.
Результаты и их обсуждение
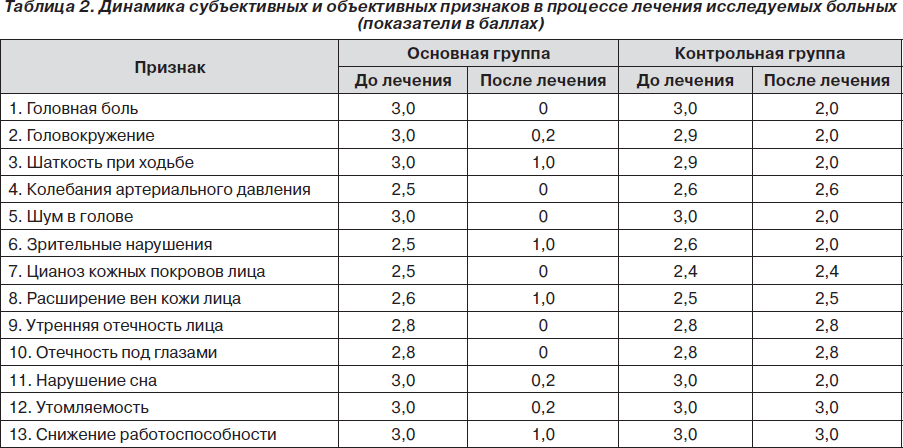
Для обследованных больных как основной, так и контрольной группы характерным было возникновение в ночные или утренние часы головной боли с ощущением тяжести в затылке, с иррадиацией в лобно-глазничную область, давлением изнутри на глазные яблоки. С нарастанием интенсивности головная боль становилась распирающей, приобретала характер диффузной, постоянной. Помимо этого, пациенты жаловались на головокружение, шум в голове, закладывание в ушах, ощущение «сетки», «пелены», «мушек» перед глазами, расстройства сна, раннее пробуждение от интенсивной головной боли. Отмечалось снижение памяти, быстрая утомляемость, снижение внимания, работоспособности. У больных была заметна пастозность лица, век, больше выраженная в утренние часы, отечность под глазами, синюшность губ, изредка кончика носа, мочек ушей, расширение вен кожи лица, приступообразное покраснение или побледнение лица. Выраженность признаков у больных соответствовала 2–3 баллам. Очаговых расстройств в неврологическом статусе не было или они носили единичный, рассеянный характер.
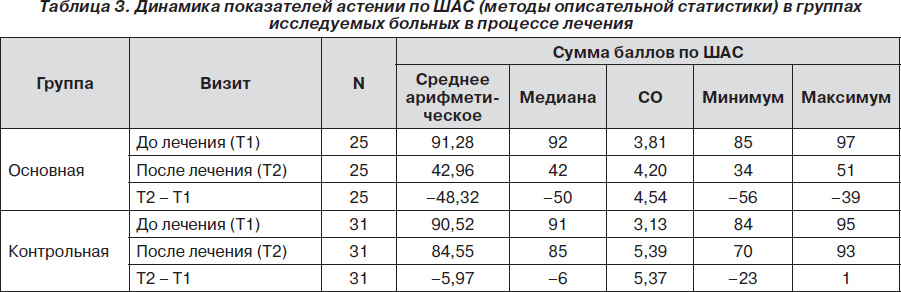
Пациенты обеих групп имели умеренную астению по категориальной ШАС. Пациенты основной группы в исходном состоянии имели уровень астении по ШАС от 85 до 97 баллов (среднее — 91,28 ± 3,81 балла), а пациенты контрольной — от 84 до 95 баллов (среднее— 90,52 ± 3,13 балла).
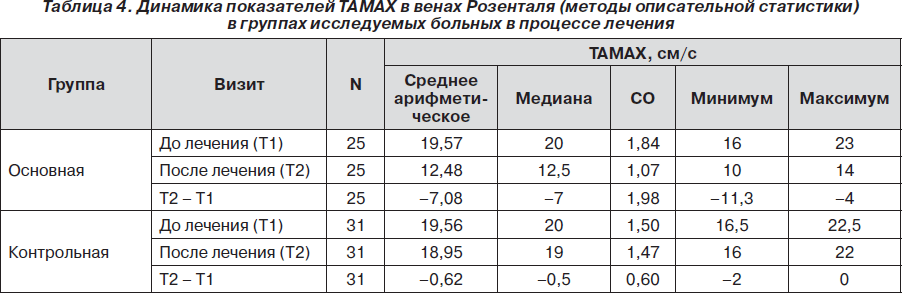
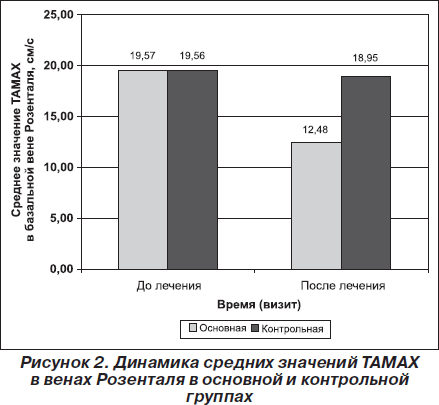
У всех пациентов по данным ТКД ТАМАХ в венах Розенталя была больше 15 см/с, что расценивалось как нарушение венозной циркуляции и проявление внутричерепной гипертензии. Так, пациенты основной группы имели ТАМАХ в венах Розенталя в исходном состоянии от 16 до 23 см/с (среднее — 19,57 ± 1,84 см/с), а пациенты контрольной — от 16,5 до 22,5 см/с (среднее— 19,56± 1,50 см/с). При офтальмоскопии у всех пациентов не прослеживалась пульсация церебрального участка ретинальной вены, что также рассматривалось в пользу ликворно-венозных нарушений.
Динамика выраженности субъективной и объективной симптоматики, степени выраженности астении по ШАС и гемодинамических показателей по данным ТКД в процессе 10-дневного курса лечения представлена в табл. 2–4.
Как видно из табл. 2–4, в процессе 10-дневного курса лечения больных с ликворно-венозными нарушениями при хронической ишемии мозга у пациентов основной группы, принимавших в комплексной терапии исследуемый препарат L-лизина эсцинат®, отмечалась четкая положительная динамика как по данным клинико-неврологического статуса, так и по показателям категориальной ШАС, данным ТКД и офтальмоскопии.
У всех больных основной группы применение на фоне базисной терапии препарата L-лизина эсцинат® способствовало клиническому улучшению в виде нивелирования головных болей, шума в голове, признаков венозных нарушений (отечность лица, век, цианоз кожных покровов лица, отечность под глазами), стабилизации АД, значительного уменьшения выраженности вестибулярных, зрительных нарушений, нормализации формулы сна, работоспособности и неврологической симптоматики. В то же время в контрольной группе существенной динамики клинико-неврологической симптоматики не было. Выраженность признаков оставалась в рамках 2–3 баллов. Различия между основной и контрольной группами по одному из важнейших направлений исследования (уменьшение выраженности клинико-неврологических признаков к концу 10-дневного курса лечения до 1 балла) были статистически значимы (р < 0,001) и свидетельствовали в пользу превышающей эффективности терапии с применением L-лизина эсцината®.
Отмечалась статистически значимая динамика показателей астенической симптоматики по ШАС. Сумма баллов по ШАС статистически значимо уменьшалась в конце курса лечения по сравнению с исходным состоянием как в основной (р < 0,001), так и в контрольной (р <0,001) группах, что свидетельствовало о влиянии терапии на данный показатель в обеих группах. Однако уменьшение количества баллов по ШАС в основной группе было более выраженным, чем в контрольной. Так, среднее значение суммы баллов по ШАС в основной группе снизилось на 52,94 % — с 91,28 ± 3,81 балла до 42,96 ± 4,20 балла, в то время как в контрольной группе — на 6,59 %, с 90,52 ±3,13 балла до 84,55 ± 5,39 балла (рис. 1).
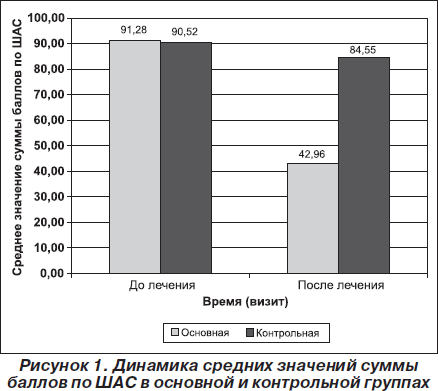
Позитивная динамика отмечалась и по показателям ТКД. ТАМАХ в венах Розенталя статистически значимо уменьшалась в конце 10-дневного курса лечения по сравнению с исходным состоянием как в основной (р<0,001), так и в контрольной (р < 0,001) группах. Однако уменьшение ТАМАХ в венах Розенталя в основной группе было более выраженным, чем в контрольной. Так, среднее значение ТАМАХ в венах Розенталя в основной группе снизилось на 36,21 % — с 19,57 ± 1,84см/с до 12,48± 1,07 см/с, в то время как в контрольной группе — на 3,15 %, с 19,56 ± 1,50 см/с до 18,95 ± 1,47см/с (рис. 2).
В процессе лечения у всех больных основной группы восстанавливалась пульсация церебрального участка ретинальной вены, тогда как в контрольной группе пульсация церебрального участка ретинальной вены в процессе лечения отсутствовала.
Выводы
1. В патогенезе цереброваскулярных заболеваний значительное место занимают ликворно-венозные нарушения, что определяет актуальность терапевтических воздействий, направленных на снижение венозных и ликворных составляющих в мозге.
2. Лекарственный препарат L-лизина эсцинат® (корпорация «Артериум», Украина) является эффективным у пациентов с ликворно-венозными нарушениями при хронической ишемии мозга.
3. Результаты клинических исследований позволяют сделать вывод, что применение на протяжении 10 дней L-лизина эсцината® по 10 мл внутривенно капельно в 50 мл физиологического раствора ведет к статистически значимой положительной динамике как по данным клинико-неврологического статуса, так и по показателям категориальной ШАС, данным ТКД и офтальмоскопии.
4. Терапия с применением L-лизина эсцината® (корпорация «Артериум», Украина) превышает по эффективности стандартную терапию в лечении ликворно-венозных нарушений у пациентов с хронической ишемией мозга, в пользу чего свидетельствуют:
— переход на более чем один уровень вниз по ШАС или уменьшение суммы баллов более чем на 25 баллов в конце 10-дневного курса приема препарата;
— нормализация показателей ТАМАХ в венах Розенталя;
— выраженность субъективных жалоб не более 1 балла.
5. Препарат L-лизина эсцинат® хорошо переносится больными, улучшает качество жизни пациентов с ликворно-венозными нарушениями при хронической ишемии мозга.
Литература1. Москаленко В.Ф., Волошин П.В., Петрошенко П.Р. Стратегія боротьби з судинними захворюваннями головного мозку // Український вісник психоневрології. — 2001. — Т. 9, вип. 1(26). — С. 5-7.2. Демографический ежегодник России. Статистический сборник. — М., 2007. — 30 с.3. Стан неврологічної служби України в 2009 році. — Харків, 2010. — 10 с.4. Варакин Ю.Я. Распространенность и структура цереброваскулярных заболеваний в различных регионах СССР по данным одномоментного эпидемиологического исследования // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2005.— №11.— С. 7-10.5. Курачицкий В.И. Эпидемиология сосудистых заболеваний головного мозга // Журнал неврологии и психиатрии им.С.С.Корсакова. — 1995. — № 2. — С. 4-9.6. Лущик У.Б., Алексєєва Т.С. Чому сьогодні не зменшуються показники захворюваності та смертності, пов’язані із серцево-судинною патологією // Практична ангіологія. — 2010.— №3(32). — С. 5-11.7. Калашникова Л.А., Кулов Б.Б. Факторы риска субкортикальной атеросклеротической энцефалопатии // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2002.— Т.7.— С. 3-8.8. Инсульт / Ворлоу Ч.П., Деннис М.С., Ван Гейн Ж., ХанпийГ.Ж., Салдерконн П.А.Г., Балефорд Ж.М., Ворлоу Ж.— 629 с.9. Early Supported Discharge of Patients with Acute Stroke. ARandomised Controlled Trial / E. Bautz-Holter, U. Sveen, T.Bruun Wyller, J. Rygh // Cerebrovascular Disease Official Journal of the European Stroke Council, Abstracts. — 9th European Stroke Conference, Vienna, Austria, May 24–27, 2000. — P. 61.10. Максудов Г.А. Дисциркуляторная энцефалопатия (сосудистые заболевания нервной системы). — М., 1975. — С.501-512.11. Шмидт Е.В., Лунев Д.К., Верещагин Н.В. Дисциркуляторная энцефалопатия. Сосудистые заболевания головного и спинного мозга. — М., 1976. — С. 227-244.12. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертензии.— М., 1997. — 288 с.13. Дамулин И.В., Захаров В.В. Дисциркуляторная энцефалопатия: Методические рекомендации. — М., 2000. — 20 с.14. Гусев Е.И. Ишемическая болезнь мозга. Актовая речь. — М.: РГМУ, 1992.15. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М., 2001. — 328 с.16. Дамулин И.В. Сосудистая деменция // Неврологический журнал. — 1999. — Т. 4. — С. 4-11.17. Мищенко Т.С., Шестопалова Л.Ф. Когнитивные и аффективные нарушения у постинсультных больных и возможности их коррекции // Международный неврологический журнал. — 2007.— № 2(12). — С. 26-30.18. Карлов В.А., Куликов Ю.А., Ильина Н.Л., ГрабовскаяН.В. Дисциркуляторная энцефалопатия у больных артериальной гипертензией // Журнал невропатологии и психиатрии им.С.С.Корсакова. — 1997. — Т. 97(5). — С. 15-17.19. Шумилина М.В. Нарушения венозного церебрального кровообращения с сердечно-сосудистой патологией: Автореф. дис… д-ра мед. наук. — М., 2002. — 44 с.20. Крыжановский Г.Н. Общая патофизиология нервной системы. — М.: Медицина, 1997. — 352 с.21. Бердичевский М.Я. Венозная дисциркуляторная патология головного мозга. — М., 1989. — 224 с.22. Бабенков Н.В. Нарушения венозного кровообращения мозга: патогенез, клиника, течение, диагностика // Журнал невропатологии и психиатрии им. С.С. Корсакова. — 1984. — Т.84, вып. 2. — С. 281-288.23. Мищенко Т.С. Вторичная профилактика ишемического мозгового инсульта // Український медичний часопис. — 2001.— № 5(25). — С. 9-17.24. Волошин П.В., Тайцлин В.И. Лечение сосудистых заболеваний головного и спинного мозга. — М.: Медпресс-информ, 2005. — 688 с.25. Табеева Г.Р. Патогенетическая терапия хронической ишемии головного мозга // Справочник поликлинического врача.— М., 2007. — № 10.26. Коркушко О.В., Лишневская В.Ю. Терапевтические возможности лечения хронической венозной недостаточности // Здоров’я України. — 2004. — № 9. — С. 3.27. Бурлай В.З., Васильева Л.В., Белименко В.А., ДейниченкоЮ.К. Эффективность применения L-лизина эсцината в интенсивной терапии раннего послеоперационного периода у больных с внутримозговыми гематомами различного генеза // Новости медицины и фармации. — 2002. — № 19–20. — С. 3.28. Горидова Л.Д. Применение L-лизина эсцината в острой фазе посттравматического периода при закрытой травме опорно-двигательного аппарата // Вісник ортопедії, травматології та протезування. — 2002. — № 3. — С. 55-57.29. Кардаш A.M., Черний В.И., Городник Г.А., Островой Е.Л. Лечение отека и набухания L-лизином эсцинатом у пациентов с опухолями головного мозга // Український нейрохірургічний журнал. — 2003. — № 3(23). — С. 37-41.30. Никонов В.В., Павленко А.Ю. Патогенетические аспекты комбинированного применения L-лизина эсцината и мексидола при травматическом отеке головного мозга // Медицина неотложных состояний. — 2006. — № 4(5).31. Новицкая-Усенко Л.В., Слива В.И. Отчет о клиническом исследовании препарата «Раствор L-лизина эсцинат 0,1% для инъекций» (3-я фаза клинических испытаний). — Днепропетровск, 2007.