Моногенные заболевания; мультифакторные наследственные болезни |
|
|
Моногенные заболевания возникают вследствие изменений в нескольких генах, которые не соответствуют норме.
- Кистозный фиброз
- Серповидно-клеточная анемия
- Болезнь Тея - Сакса
- Талассемии
- Мультифакториальные наследственные заболевания
- Врожденные пороки развития плода
Кистозный фиброз
Кистозный фиброз (КФ) — аутосомно-рецессивное заболевание, которое возникает в результате мутаций гена, который отвечает за хлоридные каналы. Почти все больные с КФ имеют хронические заболевания легких вследствие рецидивирующих инфекций, что приводит к необратимому повреждению легких и гипертрофии правого желудочка («легочное сердце»).
Около 85% больных с КФ имеют недостаточность функции поджелудочной железы вследствие хронической мальабсорбции, устойчивой к лечению. Хронические легочные болезни и их осложнения является фактором, ограничивающим жизни большинства пациентов с КФ. Выживаемость больных не превышает 30 лет.
При КФ присутствует удвоенная мутантная аллель (гомозиготность). Хотя во многих индивидах имеют место две различные аллельные мутации в одном локусе (сложная гетерозиготность), скрининг этих мутаций проводят у бессимптомных носителей заболевания. Если мать является положительной, проводят скрининг партнера. В случае его положительности риск рождения больного ребенка составит 25%. Амниоцентез выполняют с целью диагностики состояния плода.
Серповидно-клеточная анемия
Серповидно-клеточная анемия — аутосомно-рецессивное моногенное заболевание, вызванное мутацией гена бета-цепи гемоглобина, что приводит к образованию гемоглобина 8. Деоксигенированный гемоглобин 8 вызывает изменение дискообразной формы эритроцитов на серпообразную. Такие пациенты имеют гемолитическую анемию, сокращенную продолжительность жизни, страдают от болезненных серповидно-клеточных кризов вследствие окклюзии сосудов дизморфными эритроцитами.
Заболевание чаще встречается у афроамериканцев, поэтому среди этих групп населения проводят скрининг на наличие гетерозиготного носительства. Такие индивиды имеют резистентность к малярии.
Болезнь Тея - Сакса
Болезнь Тея - Сакса — аутосомно-рецессивное заболевание, которое чаще встречается у восточноевропейских евреев (носители составляют 1:27) и канадцев французского происхождения (в 100 раз чаще, чем среди других популяций), что, возможно, связано с распространенностью близкородственных связей и высокой частотой мутантного гена в популяции.
Заболевание манифестирует через 3-10 мес после рождения и характеризуется потерей живости и чрезмерной реакцией на шум. Постепенно происходит прогрессирующая дегенерация нервной системы с задержкой интеллектуальных и неврологических функций, присоединением миоклонических и акинетических судорог через 1-3 мес. У таких детей развивается паралич, слепота, деменция, и они обычно умирают до 4 лет.
Это заболевание связано с дефицитом фермента гексозаминидазы А, который отвечает за деградацию СМ2 ганглиозидов, которые концентрируются преимущественно в головном мозге. Дефицит гексозаминидазы А вызывает накопления ганглиозидов в высокой концентрации в лизосомах нейронов серого вещества головного мозга, что приводит к дисфункции и смерти клеток мозга. Скрининг на болезнь Тея-Сакса проводится в популяции женщин высокого риска, и, в случае их позитивности, их партнеров. Если оба партнера являются носителями мутантного гена, риск рождения больного потомства равно 25%.
Талассемии
Талассемии — группа генетически обусловленных гемолитических анемий, вызванных мутациями, которые вызывают редукцию синтеза а- или в-цепей молекулы гемоглобина. Потеря части цепи гемоглобина приводит к дисбалансу а:Р соотношения. Нечетная цепь глобина образует нерастворимые тетрамеры, которые осаждаются в клетках и приводят к повреждению их мембран. Итак, эритроциты подвергаются преждевременной деструкции в ретикулоэндотелиальной системе костного мозга, печени и селезенки.
Р-талассемия
Р-талассемия является аутосомно-рецессивным заболеванием, вызванным нарушением продукции р-глобина, что приводит к избытку а-цепей. Заболевание манифестирует через несколько месяцев после рождения. Присутствие в-глобина имеет важное значение лишь в постнатальном периоде, когда он заменяет а-глобин. Талассемия может быть вызвана несколькими типами мутаций (уменьшение синтеза м-РНК или специфических протеинов). Болезнь чаще наблюдается у жителей Средиземноморья, Азии и Африки. Гетерозиготные носители могут иметь легкую гемолитическую анемию; они подлежат скринингу путем проведения электрофореза гемоглобина.
а-Талассемия
а-Цепь кодируется четырьмя аллелями, поэтому у больных могут иметь место делеции и альтерации в одном, двух, трех и четырех генах, и мутации в одной или двух хромосомах (СИЗ-мутации), влияющие на тяжесть фенотипических проявлений заболевания. Тяжелые формы а-талассемии вызывают тяжелую анемию, спленомегалию, водянку и смерть плода. Электрофорез гемоглобина выявляет отсутствие НЬР, НЬА и 90-100% гемоглобина НЬа4, который известен еще под названием гемоглобина Барта.
При наличии гемоглобина Н (НЬН-болезнь) имеет место делеция гена 3аглобина, что приводит к избыточному накоплению р-цепей в эритроцитах. Бета-тетрамеры нестабильны и быстро подлежат окислению, что приводит к деструкции клеточных мембран. Такие дети рождаются с анемией; при электрофорезе гемоглобина проявляют гемоглобин Барта и некоторое количество НЬН. Через несколько месяцев гемоглобин Барта исчезает и обнаруживают гемоглобин А и гемоглобин Н.
При наличии двух делеций фенотипические проявления а-талассемии менее выражены и проявляются микроцитарной анемией. Пациенты с 1 мутацией являются бессимптомными носителями, диагноз подтверждается с помощью генетического анализа (генетическое картирование). Скрининг на а-талассемию, как и на р-талассемию проводится только в группах риска: при наличии микроцитарной анемии выполняют электрофорез гемоглобина.
Диагностика моногенных дефектов иногда может быть возможной при ультразвуковом исследовании (например, эхогенные кишки при кистозном фиброзе) или при выполнении специфических молекулярно-диагностических тестов (РСРК2-рецепторы фактора роста 2 фибробластов при синдроме Аперта (Краниосиностоз); РСРК3 при танатофорний дисплазии и ахондроплазии) .
Молекулярные методы диагностики генетических заболеваний включают следующие методы:
1. Прямой анализ мутаций является наиболее точным методом. Полимеразная цепная реакция (ПЦР) в агарозном геле используется для амплификации участка ДНК, содержащего мутацию (делецию, инверсию или дупликацию). Этот метод часто используется для диагностики мышечной атрофии Дюшенна.
2. Аллель-специфический однонуклеотидный анализ часто используется для идентификации точечных мутаций. ПЦР-продукт размещается на фильтре и гибридизируется с однонуклеотидными образцами нормального препарата и препарата с мутацией. В случае мутации он связывается с мутантным однонуклеотидным образцом и дает позитивный сигнал.
3. Анализ полиморфизма длины рестриктивного (ограничительного) фрагмента используется, если мутация создает или разрушает места распознавания дефицитных энзимов. ПЦР-продукт инкубируется с дефицитным энзимом и анализируется в агарозном геле. При наличии мутации ДНК-фрагмент, образующийся при высвобождении специфического энзима, является аномальным по размеру и мобильностью геля.
4. Сцепленный анализ используется при известной мутации гена, но если ген и мутации не характеризуемые. ДНК-маркер подводится к гену для выявления возможности трансмиссии пораженного гена и риска его наследования.
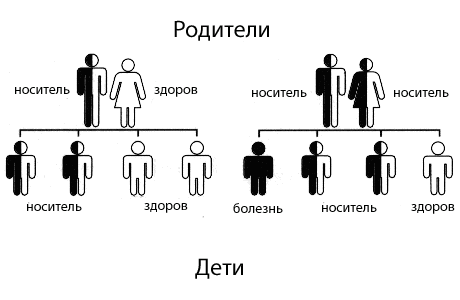
Мультифакториальные наследственные заболевания
Пороки развития часто касаются одного органа или увеличиваются у представителей одного пола. Типичными примерами мультинаследования являются дефекты нервной трубки, расщелина губы и неба, врожденные пороки сердца. Риск рецидивов мультифакториальных заболеваний при наличии заболевания в 1 родственника первой степени родства составляет 2-3%, при заболевании в 2 родственников — увеличивается до 4-6%. Непораженные носители имеют 1-2% риска у больных потомков.
Аномалии, которые имеют мультифакториальные черты, могут быть компонентами генетических синдромов с разным прогнозом и разной частотой рецидивов. Например, дефекты нервной трубки могут быть ассоциированы с поликистозом почек и полидактилией, что в совокупности составляет синдром Мекеля — аутосомно-рецессивное заболевание с частотой рецидивов 25%.
Врожденные пороки развития плода
Врожденные пороки развития могут встречаться в любой системе и органе плода, что зависит от времени действия тератогенного фактора на плод. Тератогены могут быть представлены медикаментозными препаратами, инфекционными агентами, особенно вирусными, которые могут проходить через плаценту и вызывать внутриутробную инфекцию у плода, химическими или физическими факторами (ртуть, ионизирующее излучение и т.д.).
После фертилизации яйцеклетки сперматозоидом, образованная зигота подлежит нескольким клеточным делениям и достигает стадии 16-клеточной морулы на 4-й день развития. После достижения морулы полости матки, в ней происходит излияние жидкости, которое разделяет морулы на внутренний и внешний слои — внутреннюю и внешнюю клеточную массу, и образуется бластоциста.
Бластоциста, в свою очередь, разделяется на эмбриобласт и трофобласт и имплантируется в эндометрий конце 1-й недели развития. В начале 2-й недели трофобласт начинает дифференцироваться в 2 слоя: внутренний, цитотрофобласт и внешний, синцитиотрофобласт, которые вместе создают плаценту. Вскоре внутренняя клеточная масса образует двухслойный зародышевый диск, состоящий из эпибласта и гипобласта.
В течение 3-й недели эмбрионального развития в эмбрионе происходит процесс гаструляции. Он характеризуется появлением первичной полоски в эпибласт с последующей инвагинацией эпибласта и формированием трех зародышевых слоев эмбриона: внутреннего — эндодермы, среднего — мезодермы и наружного — эктодермы. Из эндодермального слоя развиваются дыхательная система и желудочно-кишечный тракт; мезодерма дает начало сердечно-сосудистой, костно-мышечной и урогенитальной системам. Эктодерма дает начало нервной системе, коже, волосам, сенсорным органам (орган зрения, орган слуха, орган обоняния).
Наиболее уязвимым периодом внутриутробного развития относительно действия тератогенов является период органогенеза, обычно с 3-го по 8-ю неделю после оплодотворения (5-10 нед гестационного возраста), когда образуются большинство органов и систем организма.
Дефекты нервной трубки
Образование нервной трубки происходит на 22-23 день после оплодотворения (4-я неделя развития) в области 4-6 сомитов. Слияние нервной трубки происходит в краниальном и каудальном направлениях. Передняя нейропоры (будущий мозг) закрывается на 25-й день, а задняя нейропора — будущий спинной мозг — закрывается на 27-й день. Закрытие нервной трубки совпадает с установлением ее собственного кровоснабжения. Большинство дефектов нервной трубки развивается вследствие дефекта ее закрытия на 4-й неделе развития (6-я неделя гестационного возраста).
Дефекты нервной трубки, в частности анэнцефалия и щель позвоночника является классическим примером мультинаследования, демонстрирующие сочетания генетических факторов окружающей среды. Существуют значительные географические и этические вариации частоты этих пороков развития.
Доказано, что уменьшение уровня фолиевой кислоты в крови матери ассоциировано с развитием дефектов нервной трубки у плода. Итак, преконцепционная профилактика путем применения фолиевой кислоты перед оплодотворением и в течение беременности позволяет значительно снизить частоту дефектов нервной трубки, в том числе их рецидивов. Кроме того, риск дефектов нервной трубки увеличивается вдвое в случае гомозиготности по мутации С677Т в гене, кодирующем фермент метилтетрагидрофолатредуктазы с уменьшенной активностью. Но доля этих мутаций в развитии дефектов нервной трубки не является значительной. Риск дефектов нервной трубки при определенном генотипе может сильно варьировать в зависимости от материнских факторов риска, в частности уровня витамина В12 или фолатов в сыворотке крови.
Анэнцефалия (экзенцефалия) возникает вследствие нарушений процесса закрытия краниальной части нервной трубки с частотой 1: 1500 новорожденных, чаще повреждается плод женского пола. При этом свода черепа вообще не образуется, а аномальный мозг остается открытым, дегенерирует и вымывается амниотической жидкостью. За отсутствия у плода механизма глотания этот недостаток развития сопровождается многоводием в последние месяцы беременности.
Плоды с щелью позвоночника могут быть обнаружены при ультразвуковом обследовании, при котором может визуализироваться не один открытый спинномозговой канал, а ассоциированные с ним признаки. Часто ассоциированными аномалиями могут быть вентрикуломегалия (расширение желудочков мозга) и согнутые ступни. До широкого внедрения ультразвуковой в реальном масштабе времени, скрининговым тестом на пороки развития нервной трубки был только уровень а-фетопротеина (АФП) в сыворотке крови матери. Открытая нервная трубка плода приводит к увеличению уровня АФП в амниотической жидкости и, соответственно, в крови матери.
Функции новорожденных со щелью позвоночника зависят от уровня поражения спинного мозга. Если щель позвоночника локализуется низко в крестцовой области, функция мочевого пузыря и кишечника может быть не нарушена. Но в большинстве случаев имеется полная потеря функций мочевого пузыря, кишечника и нижних конечностей.
Небольшие дефекты черепа, сквозь которые выпирают ткани головного мозга (грыжа головного мозга, энцефалоцеле) и / или мозговые оболочки (грыжа мозговых оболочек, менингоцеле), являются довольно частыми и могут быть устранены хирургическим путем.
Гидроцефалия (водянка головного мозга) характеризуется чрезмерным накоплением спинномозговой жидкости в системе желудочков мозга. Возникает вследствие стеноза сильвиевого водопровода, когда спинномозговая жидкость из боковых и третьего желудочков не имеет оттока в четвертый желудочек и далее в подпаутинное пространство.
Синдром Арнольда-Киари обусловлен смещением мозжечка в каудальном направлении и его ущемлением в большом отверстии. Этот порок сопровождает почти все случаи кистозной расщелины позвоночника и часто сочетается с гидроцефалией.
Микроцефалия проявляется уменьшением свода черепа вследствие аномального развития мозга. Недостаток может передаваться по аутосомно-рецессивному типу или быть связан с пренатальной инфекцией, действием медикаментозных препаратов или других тератогенов.
Врожденные пороки сердца
Существуют многочисленные варианты структурных аномалий сердца, сопровождающихся изменениями физиологических основ деятельности сердечно-сосудистой системы. Развитие сердца начинается на 3-й неделе после оплодотворения, когда ангиогенные клеточные кластеры образуются в переднецентральной зоне эмбриона.
Одновременно со сгибанием эмбриона в цефалокаудальном направлении кардиогенный участок также сгибается и образует сердечную трубку. Даже в этой ранней стадии эмбриональное сердце уже получает венозную кровь из каудального конца и выталкивает кровь через первую аортальную дугу в дорзальной аорту. В это время мезодерма окружает сердечную трубку тремя слоями клеток, которые образуют уровни: внешний — эпикард, средний — миокард и внутренний — эндокард. Между 23 и 28-м днями сердечная трубка удлиняется и образует сердечную петлю с общим предсердием и узким атриовентрикулярным соединением, соединяющим его с первичным желудочком.
Луковица сердца в каудальной части сердечной трубки образует три структуры: проксимальная треть дает начало трабекулярной части правого желудочка; средняя часть формирует выходной тракт желудочков, а дистальный сегмент итоге образует проксимальную часть аорты и легочную артерию.
Между 27 и 37-м днями сердце продолжает развиваться путем создания основной перегородки. Формирование перегородки происходит за счет ткани эндокарда (эндокардиальных валиков), которая разделяет его пространство на две полости. Правое и левое предсердия образуются благодаря развитию первичной и вторичной перегородки, разделяющей первичное предсердие, хотя оставляет межпредсердное отверстие, или овальное отверстие, для возможности шунта (сброса) крови справа налево.
На 4-й неделе эндокардиальные валики вновь появляются в предсердно-желудочковом канале и образуют правый и левый каналы, а также митральный и трикуспидальный клапаны. В течение этого времени медиальные стенки желудочков постепенно сливаются друг с другом и образуют мышечную часть межжелудочковой перегородки.
Артериальный конус вступает в среднюю часть луковицы сердца, и в течение 5-й недели развития эндокардиальные валики подразделяют его на выходные пути для правого и левого желудочков, а также на оболочечную часть межжелудочковой перегородки. Эндокардиальные валики появляются также в артериальном стволе — дистальной трети луковицы сердца — и растут в виде спирали, формируя аортопульмонарную перегородку, разделяя артериальный ствол на аортальный и пульмональный тракт.
Любой этап развития сердца может быть нарушен, что приведет к образованию аномалий. Так, например, если стенки желудочков не соединятся, образуется дефект межжелудочковой перегородки, что при отсутствии хирургического лечения, приведет к развитию синдрома Эйзенменгера (гипертрофия правого желудочка и легочная гипертензия, шунт крови «справа налево»). Одной из наиболее частых пороков развития сердца тетрада Фалло, которая включает дефект межжелудочковой перегородки, декстра- позицию аорты, стеноз или атрезия легочной артерии и гипертрофию правого желудочка. Может встречаться транспозиция сосудов, когда аорта и легочная артерия соединяются в одном желудочке. Другие аномалии включают коарктацию аорты, открытый артериальный проток (также приводит к развитию синдрома Эйзенменгера).
Ультразвуковой скрининг аномалий развития сердца зависит от качества ультразвуковой визуализации сердца. Многие пороки развития, включая коарктацию аорты, дефект межжелудочковой и межпредсердной перегородки, часто невозможно обнаружить при ультразвуковом обследовании.
Последствия врожденных пороков сердца очень варьируются. Большинство из них подлежат хирургической коррекции. Такие пороки, как гипоплазия левых отделов сердца, обычно являются некурабельных и больные часто умирают в молодом возрасте.
Синдром Поттера
Синдром Поттера возникает вследствие почечной недостаточности, которая приводит к выраженному маловодию (ангидрамнион), что, в свою очередь, вызывает гипоплазию легких и контрактуры у плода. Под болезнью Поттера понимают двустороннюю агенезию почек. Почечная недостаточность может развиваться у плода также вследствие обструкции мочевых путей.
Отросток мюллеровых протоков — зачаток мочеточника — расширяется и разделяется с образованием мочевыводящей системы — трубочек, чашечек, почечных лоханок и мочеточников у мужчин и женщин. При наличии тестостерона, мезонефральный проток у мужчин также дает начало семявыносящему протоку, придаткам яичка, эякуляторному протоку и семенным пузырькам.
У женщин эти дополнительные протоки дегенерируют, за исключением остаточной (рудиментарной) гартнеровой протоки, которая может образовывать доброкачественные кисты за ходом широкой связки матки.
Третья почечная система — окончательная почка — также возникает на 5-й неделе гестации и начинает функционировать около 9-й недели. Зачаток мочеточника из мезонефрального протоков контактирует с окончательной почкой — метанефрос — и побуждает его к образованию нефронов. Если этот контакт не происходит, имеет место агенезия почек. Прилегающая дорзальная аорта отдает коллатерали в метанефрос для завершения развития почечных клубочков.
До 7-й недели клоака (проксимальная часть аллантоиса, что в дистальном конце контактирует с желточным мешком) разделяется на 2 части: урогенитальный синус и аноректальной канал. В течение этого процесса каудальная (наибольшая) часть мезонефрального протока абсорбируется. Почка мочеточника уже не является частью мезонефрального протока, а соединяется непосредственно с урогенитальным синусом.
Из урогенитального синуса образуется мочевой пузырь и из зачатков мочеточника — мочеточники. Урогенитальный синус продолжается в мочеиспускательный канал каудально и в алантоис краниально. После облитерации аллантоиса остается урахус — фиброзный тяж, который позже становится медиальной пупочной связкой у взрослых.
Агенезия почек является тяжелой патологией. При отсутствии почек плод может удалять продукты метаболизма через плаценту, но это приводит к отсутствию околоплодных вод (агидрамниона). Без амниотической жидкости легкие плода не испытывают постоянного давления, побуждающего их к расширению и росту. Это вызывает гипоплазию легких. Кроме того, при отсутствии амниотической жидкости плод не имеет возможности двигаться, что приводит к формированию контрактур конечностей плода. Попытки ввести амниотическую жидкость в плодный пузырь при амниоцентезе оказались безуспешными вследствие его быстрой абсорбции.
Введение постоянного катетера в амниотическую полость несет высокий риск инфекции. Итак, на сегодня отсутствует адекватное лечение синдрома Поттера. Но при синдроме Поттера, вызванном вторично вследствие исходной обструкции мочевого пузыря, является возможность введения катетера в мочевой пузырь или выполнения лазерной абляции места обструкции.
Врожденный поликистоз почек возникает с частотой 1: 500-1: 5000 новорожденных и наследуется по аутосомно-рецессивному или аутосомно-доминантному типу.
Экстрофия мочевого пузыря — это дефект вентральной стенки, при котором слизистая оболочка мочевого пузыря остается обнаженной. Это редкая аномалия с частотой 1: 100 000 новорожденных.
Существуют многочисленные аномалии почек (седловидная почка, эктопическая почка, удвоение мочеточника), которые остаются недиагностированными и обычно не имеют серьезных проблем.



